Химия
Основы химии. Учебник.
Ответы к задачам
Глава 1.
1.3. На тепловой станции. 1.7. (б). 1.8. Озон, кислород, азот. 1.9. Вода в реке; воздух. 1.11. (б) “Молекула воздуха”. 1.12. (г). 1.13. (б). 1.14. Смесь. 1.15. а) сложным; б) 4H2O и 9CO2; в) 9O2; д) C9H8O4 + 9O2 = 9CO2 + 4H2O; е) 9CO2 + 4H2O = C9H8O4 + 9O2. 1.16. Черная копоть (сложное вещество древесина превратилось в простое вещество углерод; остальные явления - физические).
Глава 2.
2.1. 8p + 8n. 2.2. 5p + 6n + 5e. 2.3. 10e. 2.4. Ca+2. 2.5. (0,573.120,9 + 0,427.122,9) = 121,75. 2.6. 63Cu 75%, 65Cu 25% (для заданной точности вычислений).
2.7.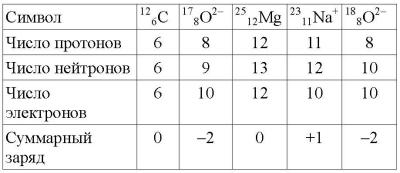
2.10. Фосфор (P). 2.15. 1p, 2d, 3f. 2.16. 10e + 10p. 2.17. 19K. 2.18. Доноры: Na (1e), Al (3e), Mg (2e); акцепторы: O (2e), F (1e). 2.20. 7N (внешняя электронная оболочка ближе к ядру). 2.21. Элемент ванадий 23V: ...4s2 3d3. 2.22. 17Cl ядовит (сильный акцептор электронов), 18Ar - инертный газ. 2.24. Na2+ (больше протонов в ядре). 2.25. a) F-, б) Na, в) Ne, г) Na+. 2.26. Sb; n = 5, l = 1, m = +1, s = +1/2. 2.27. Ni; n = 3, l = 2, m = 0, s = -1/2. 2.29. n = 4, l = 0, m = 0, s = +1/2. 2.30. 3d2 (Ti). 2.31. 4p4 (Se), 2 неспаренных электрона. 2.32. 2p5 (F), ближайший Ne. 2.33. а) Si (2), б) S (2), в) Fe (4). 2.35. свинец - plumbum (лат.); сурьма - antimony (англ.) (но stibium - лат.).
Глава 3.
3.1.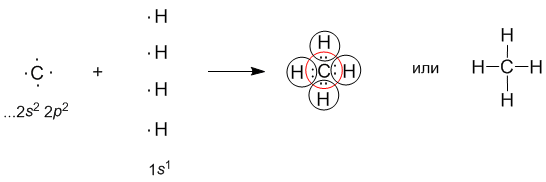
3.4. F–Ca–F (структурную формулу можно записать так, хотя связь Ca–F ионная, как выяснится в §3.4), две связывающие и 6 неподеленных электронных пар на атомах фтора. 3.5. б) H:C:::C:H (формула Льюиса), кратность три. 3.6. а) H:C:::N: 3.7. Sc (III), ScCl3, полярная ковалентная либо ионная. 3.8. 1): в) CaH2, г) AlF3, д) Al2O3. 3.10. I2 - ковалентная связь. 3.11. 4s2 4p4, H2Se - 2 поделенные, 2 неподеленные эл. пары. 3.12. 6 поделенных и 18 неподеленных эл. пар. 3.13. иод (II). 3.16. Соединение PH3 (фосфин) существует - электроны трех атомов водорода дополняют внешнюю оболочку фосфора до октета, делая ее похожей на внешнюю оболочку аргона; соединение PH5 не существует - электроотрицательность атомов водорода недостаточна для того, чтобы "освободить" внешнюю оболочку фосфора от электронов и сделать ее похожей на электронную оболочку инертного газа неона. 3.17. Структурные формулы: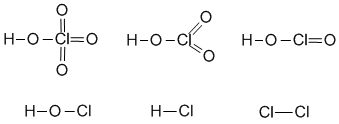
Из аналогичных соединений фтора существуют только F2, HF и фторноватистая кислота HFO (неустойчивое соединение, имеющее строение H–O–F); остальные кислородные кислоты фтора существовать не могут, т.к. у фтора высокая электроотрицательность и, кроме того, на 2-м (внешнем) уровне нет d-орбиталей; в отличие от хлора, фтор не проявляет переменной валентности. 3.19. AlCl3 (sp2, плоский треугольник), AlCl4- (sp3, тетраэдр). 3.20. Меньше 109о. 3.21. Cl sp3. 3.22. SbF6- октаэдр (фигура с 6 вершинами и 8 треугольными гранями). 3.23. а) BH3 (sp2), б) BeH2 (sp), в) PH3 (sp3 - есть неподеленная пара у P). 3.24. BF4- (sp3, тетраэдр), AlF63- (sp3d2, октаэдр).
3.26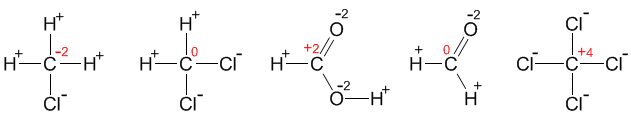
3.28. SiH4, H2SO3, MgCO3, C2H2. 3.31. а) Al2O3, б) P2O5, в) FeS, г) Fe2O3. 3.32. Fr ...7s1 (I). 3.33. Se (II, IV, VI). 3.34. SiO2 полярное ковалентное, ΔX = (3,44 - 1,90) = 1,54. 3.35. F2 ковалентное. 3.37. NaCl + F2 = NaF + FCl. 3.38. а) Вкусовые рецепторы языка имеют химическую природу. Химические свойства частицы зависят не только от строения ее внешней электронной оболочки, но и от электрического заряда всей частицы (заряд влияет на способность молекулы или иона связываться со вкусовым рецептором). б) В лаборатории запрещается готовить и принимать пищу, брать для этого какие-либо вещества и использовать посуду.
Глава 4.
4.1. S, Se, Te (ns2 np4). 4.2. Окислители: N, Cl. 4.3. Li+, Sr2+, Al3+, Ti4+, At-. 4.4. NH3, PH3, N2O5, P2O5. 4.7. Lu (...5d1), аналог Sc и Y - см. 4.4. 4.8. 102No (нобелий). 4.9. 10Ne, RfCl4. 4.10. 11Na, I группа. 4.12. В 4-м периоде от K до Zn). 4.13. а) Сера; б) у мышьяка. 4.14. Cs активнее чем Na взаимодействует с водой (внешняя оболочка Cs более удалена - легче отдает электроны). 4.15. На атоме Cl частичный отрицательный заряд, на атоме I - частичный положительный.
Глава 5.
5.3. Не изменилась. 5.4. 9,6 г (Cu + S = CuS). 5.5. 88 г (Fe + S = FeS, серы в конечной смеси нет). 5.6. CaCO3 (20 г) = CaO (11,2 г) + CO2 (8,8 г); CaO + H2O = Ca(OH)2 + теплота. 5.8. 4 моль O2. 5.9. 2 моль (64 г) O2; 92 г NO2. 5.10. 6.1024 молекул H2O или 10 моль H2O. 5.11. 1 моль CaCl2 (111 г). 5.12. CaCl2 0,1 моль, 11,1 г; Cl2, 0,1 моль, 7,1 г. 5.13. 2 моль (36 г) H2O. 5.14. 1 моль (32 г) O2. 5.15. 0,0033 моль = 0,132 г пропина; 6,6.10-23 г. 5.16. 44,8 л N2. 5.17. 44,8 л Ar. 5.18. 0,089 г/л H2; 0,178 г/л He; водород выгоднее. 5.19. 0,3 моль (9,6 г) O2. 5.20. 0,714 г/л CH4. 5.21. 71 г, 71 а.е.м., Cl2. 5.22. 30 а.е.м, NO. 5.23. 1,52 г/л H2S. 5.24. На Венере (но не на Земле) можно летать на “воздушных” шарах, наполненных H2S. 5.25. 18.1023 молекул HF; 67,2 л F2. 5.26. 98 моль, 196 г, 2195 л H2. 5.27. 10 г (0,1 моль) CaCO3. 5.28. Не менее 1,24 л. 5.30. 0.75 л CO2 и 0,6 г H2O. 5.31. 39 г Na, 19 л Cl2. 5.32. 0,1 моль/л HCl. 5.33. 44013 л или 44 м3 CO2. 5.36. 0,4 моль Cr. 5.37. 16 г CH4. 5.38. 40 г Fe2O3. 5.39. В 2 раза. Надо было взять 24 г Mg (Юх спутал атомный номер с атомной массой). 5.40. а) N2 : H2 : NH3 = 1:3:2 (по объему); б) 34 г NH3. 5.41. 35 кг песка. 5.42. Перетянет чашка с растворенным цинком. 5.43. Взорвалось 1,12 л H2. 5.44. Останется 3 мл O2.
5.45 (в уравнениях подчеркнуты главные коэффициенты, к которым привязываются все остальные):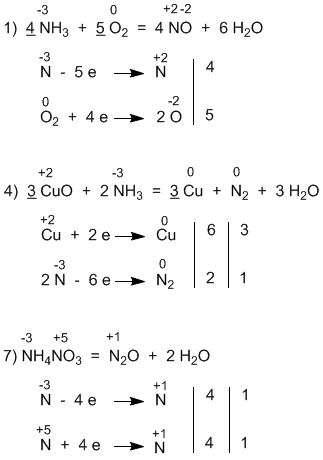
5.46. 6,72 л O2.
5.47 (в уравнениях подчеркнуты главные коэффициенты, к которым привязываются все прочие):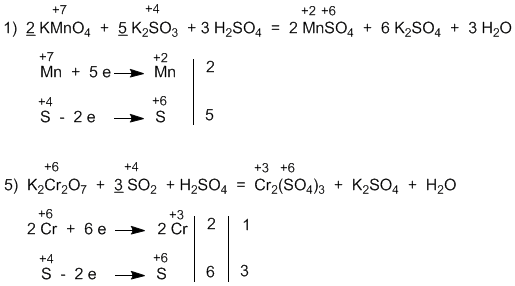
5.49 1) реакция межмолекулярного окисления восстановления, 4) внутримолекулярное окисление-восстановление, 2) и 3):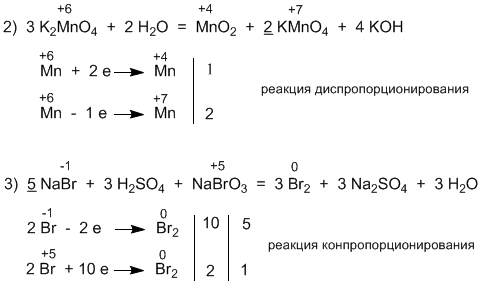
Глава 6.
6.1. 3 кг 744 г (48 моль) Na2O2. 6.2. 249 моль O2; 26,56 м3 воздуха. 6.3. 45 г KNO3. 6.5. 1,3 г HgO (с учетом, что в сосуде уже есть 21% или 210 мл O2 из воздуха).6.7. SiO2, SeO2, SeO3, SrO, B2O3, Sc2O3. 6.8.4,0 г Ca. 6.10. 66,7% PbS переработать в PbO. 6.11. 52 а.е.м. (Cr). 6.12. 15 моль (336 л) O2, 320 г S. 6.14. 32 г/22,4 л (O2) больше, чем 28 г/22,4 л N2. 6.15. 1,428 г/л. 6.16. 53%. 6.17. H2CO3 угольная кислота. 6.18. 3CuO + 2CO2 + H2O.
Глава 7.
7.1. D (10 молярн. %), H (90 молярн. %); примечание: наличие молекул HDO аналогично смеси молекул H2O и D2O = 1:1, что не влияет на значение средней молярной массы. 7.2. 3,27 г (0,05 моль) Zn. 7.3. 40 г NaOH, 11,2 л H2. 7.4. 1792 л (н.у.), 8360 л (1000 оС). 7.5. 448 л H2. 7.6. 45 г H2O. 7.7. 91,3 кг Fe, 159,8 кг H2SO4. 7.9. 2,66 моль NH3. 7.10. 36 г H2O, 196 г H2SO4. 7.12. CaCl2.4H2O. 7.13. Al2(SO4)3.18H2O. 7.14. 34,8 г KBr. 7.15. 11,1 г/100 г H2O. 7.16. 450 г. 7.17. Из Na. 7.18. 4 т жидкого H2. 7.19. 1) 2Cu + O2 = 2CuO; 2) CuO + H2 = Cu + H2O. 7.20. Останется 5 мл O2. 7.21. 180 г (10 моль) H2O. 7.22. 5 г NaCl. 7.23. 65,36 мл, 50 г NaOH. 7.24. 9,5 г спирта и 0,5 г иода. 7.25. Получился 20% раствор KOH. 7.26. 51,5 г NaBr. 7.27. 50,5 г KNO3. 7.28. 1,33 мл H2SO4. 7.29. 3.1023. 7.30. 2M р-р H2SO4. 7.31. 19,1M NaOH. 7.32. 55,5M, 100%. 7.33. Во 2-м случае: KBr и KOH. 7.34. 22,3%-ный р-р CaCl2. 7.35. 16,5 г CaCl2. 4H2O + 183,5 мл H2O.
Глава 8.
8.3. 13,6 г CaSO4. 8.4. 4,9 г H2SO4. 8.9. 22,4 л SO3. 8.11. 284 кг P2O5. 8.12. CuO (0,05 моль) 4 г, ZnO (0,08 моль) 6,48 г; примечание: примите x моль CuO, y моль ZnO и составьте систему уравнений с использованием значений 10,48 г и 20,88 г. 8.13. В порядке повышения кислотности: H2O < H2S < H2Se <
H2Te < H2Po. 8.14. 100 мл. 8.15. 0,16М HBr. 8.16. 2,8М HCl. 8.17. 0,0042 г/м3 или 4,2 мг/м3 HCl в воздухе. 8.22. NaOH или KOH. 8.25. 0,05 моль (4,9 г) H2SO4 и 0,07 моль (2,8 г) NaOH. 8.26. 0,01 моль K2HPO4 и 0,01 моль K3PO4.
8.27.
2) Pb(NO3)2 + K2S = PbS↓ + 2 KNO3
5) Na2S + 2 HCl = H2S↑ + 2 NaCl
6) (NH4)2SO4 + 2 KOH = 2 NH4OH + K2SO4; однако NH4OH может разлагаться с выделением аммиака, поэтому в итоге: (NH4)2SO4 + 2 KOH = 2 NH3↑ + 2 H2O + K2SO4
7) K2CO3 + H2SO4 = H2CO3 + K2SO4; однако H2CO3 разлагается на углекислый газ и воду, поэтому в итоге: K2CO3 + H2SO4 = CO2↑ + H2O + K2SO4 (в реакции бурно выделяется углекислый газ)
8) Ba(HCO3)2 + H2SO4 = 2 CO2↑ + 2 H2O + BaSO4↓ (в реакции бурно выделяется газ и выпадает осадок)
9) Al2O3 + 2 KOH = 2 KAlO2 + H2O (при нагревании) и Al2O3 + 2 KOH + 3 H2O = 2 K[Al(OH)4] (при реакции с раствором KOH)
12) NaHCO3 + NaOH = Na2CO3 + H2O (частный случай реакции нейтрализации - из кислой соли получают среднюю соль)
13) [Cu(OH)]2SO4 + 2 KOH = 2 Cu(OH)2↓ + K2SO4 (из малорастворимой основной соли получают нерастворимое основание)
14) [Cu(OH)]2SO4 + H2SO4 = 2 CuSO4 + 2 H2O (из основной соли получают среднюю соль - вариант реакции нейтрализации)
17) K2S + HNO3 = KHS + KNO3 (реакция идет, поскольку H2S - слабая кислота; однако при недостатке HNO3 образуется не H2S, а ее кислая соль)
18) 2 Mg(OH)2 + H2SO4 = [Mg(OH)]2SO4 + 2 H2O (в реакции нейтрализации при недостатке кислоты образуется не средняя, а основная соль).
8.30. а) гидроксид; б) кислота; в) основной оксид; г) кислотный оксид; д) кислота. 8.33. KCl + AgNO3. 8.34. Mg + NiCl2 = Ni + MgCl2. 8.35. FeCl3 + 3NaOH = Fe(OH)3 (осадок) + 3NaCl. 8.36. 0,2M HCl. 8.37. 120 г NaHSO4. 8.38. NaHCO3 (0,06 моль) и Na2CO3 (0,01 моль). 8.39. BaCl2 + Na2SO4 = BaSO4 (осадок) + 2NaCl (сульфат бария настолько малорастворим, что не способен быть ядовитым, как многие другие, растворимые соли бария). 8.42. 0,25 моль (77,5 г) Ca3(PO4)2. 8.43. а) NH4Cl, б) NaHSO4, в) Na2CO3, г) Mg(OH)Cl. 8.46. 27,7% раствор (NH4)H2PO4 (дигидрофосфат аммония); примечание: 46 г соли содержатся в 166 г раствора. 8.47. 20,7 г Pb; примечание: растворилось x моль Zn и выделилось x моль Pb (80 - 65,4x + 207x = 94,2). 8.49. Be3Al2Si6O18 или 3BeO.Al2O3.6SiO2.
Глава 9
9.1. 1386 кДж (реакция экзотермическая). Для решения задачи можно почленно сложить уравнения (а) и (б) (при этом сократится SO2) и умножить получившееся уравнение на два.
9.2. Графит более устойчив, т.к. при его сгорании выделяется меньше энергии.
9.3. Ca (тв) + 1/2 O2 (г) = CaO (тв) + 660,8 кДж. Для решения можно переписать уравнение (в) в таком виде: H2O = 1/2 O2 + H2 – 286 кДж. После этого следует вычесть оба уравнения (б) и (в) из уравнения (а).
9.4. При превращении черного фосфора в белый поглощается 38 кДж/моль (реакция эндотермическая).
9.5. Эндотермическими реакциями (протекающими с поглощением энергии из внешней среды) являются реакции (а) и (в), для которых значения ΔНо298 положительны.
9.6. Для решения можно воспользоваться уравнением (г) из задачи 1.5. Ответ: 143 кДж.
9.7. 431,5 кДж/моль (такую энергию надо затратить, чтобы "разорвать" 1 моль молекул HCl на составляющие атомы по уравнению: HCl = H + Cl).
9.8. ΔНо298 = –297 кДж.
9.10. Реакция ржавления железа имеет более низкую энергию активации (протекает, хотя и медленно, уже при комнатной температуре).
9.13. а) Реакция (1) будет протекать быстрее, так как у нее более низкая энергия активации; б) 3-й суммарный порядок у реакции (1); в) 2-й суммарный порядок у реакции (2); г) Реакция (1) – тримолекулярная; д) Реакция (2) – бимолекулярная.
9.14. [A]н = 0,24 моль/л, [Б]н = 0,6 моль/л.
9.15. В 8 раз. Увеличить давление вдвое можно, уменьшив в два раза объем смеси. Концентрация реагентов (в моль/л) при этом увеличивается вдвое. Полученные значения надо подставить в кинетическое уравнение.
9.16. [А] = 1,5 моль/л; v = 0,8[1,5][0,5] = 0,6 моль/л.сек.
9.17. [А] = 0,5 моль/л; v = 0,1 моль/л.сек.
9.18. В 43 или в 64 раза.
9.19. Следует повысить температуру на 50 оС.
9.20.Температурный коэффициент γ = 3,5 (примечание: корень 4-й степени извлекается с помощью калькулятора - надо дважды извлечь квадратный корень).
9.21. Возрастет в 5832 раза (увеличение в 8 раз дает повышение давления и в 729 раз - повышение температуры на шесть 10-градусных интервалов).
9.22. В реакциях 2) и 5).
9.23. В реакции 5).
9.24. [В]р = 1 моль/л, [А]р = 2 моль/л.
9.25. Скорость прямой реакции увеличится в 8 раз, а обратной только в 4 раза. В результате равновесие сдвинется вправо.
9.27. Раз речь идет о повышении температуры, две первые экзотермические реакции отпадают. Из оставшихся двух равновесие больше сдвинется вправо в реакции 3).
Глава 10
10.1. а) Кд = [H+]·[NO2–]/[HNO2], б) Кд = [Li+]·[OH–]/[LiOH], в) Кд = [H+]·[ClO–]/[HClO].
10.2. 55 молекул Н2О на 1 ион (20 г NaOH это 0,5 моль NaOH; в случае полной диссоциации в растворе присутствует 0,5 моль ионов Na+ и 0,5 моль ионов ОН–, в сумме (0,5 + 0,5) = 1 моль ионов; 1 л Н2О это 1000 г Н2О или 55,5 моль Н2О; соотношение молей, а, следовательно, и частиц: 55,5 : 1 = 55).
10.3. Ответ в материале 2-го уровня (**) параграфа 2.1. Школьник не усвоил тему "строение атома".
10.4. 1) В лаборатории нельзя работать без халата; 2) Работать с твердыми щелочами (NaOH, KOH) можно только под вытяжном шкафом с хорошей вентиляцией – твердая щелочь "пылит" и при случайном вдыхании может вызвать химический и термический ожог слизистой носа или бронхов – тем более нельзя энергично вытряхивать остатки щелочи из банки! 3) Работать с едкими щелочами (твердыми или водными) разрешается только в защитных очках. Твердая щелочь менее опасна при случайном попадании на сухую кожу, чем на влажную, и особенно опасна при попадании в глаза. Водные щелочи обладают едкими свойствами благодаря присутствию в растворе реакционноспособных ионов ОН–, образующихся в результате диссоциации. Кроме того, гидратация ионов ОН– сопровождается выделением большого количества теплоты. При случайном попадании щелочи на руки или в глаз ее необходимо смыть большим количеством холодной проточной воды, а глаза еще и обязательно промыть 1%-ным раствором уксусной кислоты, который всегда должен быть наготове в каждой химической лаборатории. Для этих же целей (а не для красоты, как многие думают) над раковинами в химических лабораториях укрепляют зеркала.
10.5. Прибавить 900 мл воды. Решение: пусть С1 = 0,2 моль/л – исходная концентрация, а С2 – неизвестная концентрация кислоты после разбавления. Воспользуемся законом разбавления Оствальда для слабых электролитов: К = α2С. По условию степень диссоциации после разбавление должна удвоиться (α2 = 2α1). Тогда: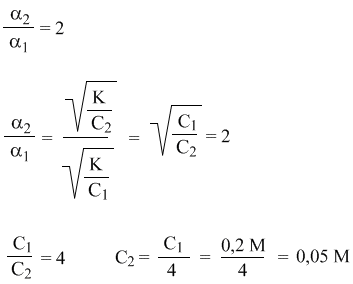
Следовательно, из 300 мл 0,2 М раствора надо добавлением воды приготовить 0,05 М раствор кислоты. Можно решать эту задачу, но проще воспользоваться уже имеющимся результатом: мы выяснили, что С2 = С1/4, т.е. конечная концентрация раствора должна быть в 4 раза меньше исходной. Следовательно, раствор надо просто разбавить в 4 раза. Объем 1200 мл в 4 раза больше 300 мл. Поэтому для разбавления в 4 раза следует добавить в исходный раствор 900 мл воды (1200 мл – 300 мл). Если теперь сделать проверку, то можно убедиться, что полученный раствор действительно имеет нужную концентрацию 0,05 моль/л (молярная масса уксусной кислоты СН3СООН – 60 г/моль).
10.6. Добавить 1600 мл воды (разбавить раствор в 9 раз – т.е. довести до объема 1800 мл).