Химия
Беседа о самом необыкновенном в мире веществе
Высокотемпературные топливные элементы
Электрохимическое окисление топлива не всегда протекает гладко. Такие распространенные и дешевые виды топлива, как генераторный газ (основное содержание — окись углерода СО) или природный газ, состоящий главным образом из метана СН4, реагируют на электродах значительно медленнее, чем водород. А малая скорость реакции означает малую плотность тока и, следовательно, малую мощность.
Эти реакции можно проводить с достаточной скоростью, если использовать высокие температуры, например 500 или даже 1000° С. Но тут возникает новая трудность: при высоких температурах водный раствор электролита оказывается неподходящим — вода испаряется мгновенно. Для таких температур электролитами могут служить либо расплавы солей (например, смесь углекислых солей натрия, калия и лития, плавящаяся при температуре чуть ниже 500° С), либо твердые электролиты.
Твердый электролит — двуокись циркония (ZrО2) содержит некоторые примеси. При температуре около 800—1000° С двуокись циркония благодаря подвижности отрицательных ионов кислорода О2- начинает хорошо проводить электрический ток (катионы Zr4+ не перемещаются и ток не переносят). Такая «кислородная» проводимость влияет на характер электрохимических реакций, протекающих на электродах. Если построить элемент такого типа — вместо раствора КОН взять в качестве электролита ZrO2 — и подводить к одному электроду окись углерода, а ко второму — кислород, то при температуре около 1000° С молекулы кислорода на электроде станут принимать электроны из внешней цепи, превращаясь в отрицательные ионы: О2+4е->2О2-, а молекулы СО топливного электрода соединятся с ионами О2- из твердого электролита, образуя углекислый газ и отдавая электроны во внешнюю цепь:
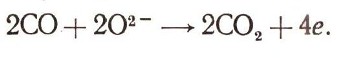
Электрический ток во внешней цепи компенсируется движением ионов О2- в твердом электролите. Такие высокотемпературные топливные элементы, питаемые генераторным газом и кислородом, могут работать при плотностях электрического тока 50— 150 мА/см2 напряжением около 0,5 В на элемент.
2i.SU ©® 2015