Химия
Беседа о самом необыкновенном в мире веществе
Что такое электрохимия
Проблемой непосредственного превращения химической энергии в электрическую и электрической в химическую занимается электрохимия. Эта наука зародилась в начале XIX в. В наши дни она переживает свою вторую молодость.
Электрохимические реакции отличаются от обычных химических реакций тем, что в них участвуют свободные электроны. В ходе такой реакции свободные электроны либо выделяются, либо поглощаются. Примерами первых реакций могут служить реакции растворения металлов:

или реакции выделения кислорода на положительном электроде при электролизе воды:
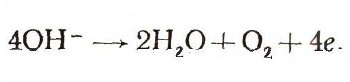
Реакции с отдачей электронов — окислительные (металлический цинк, отдавая электроны, окисляется до двухвалентного состояния). Пример восстановительных реакций — реакции отложения металлов из растворов, например:
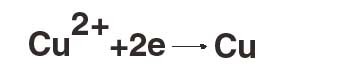
или реакция электролитического выделения водорода:
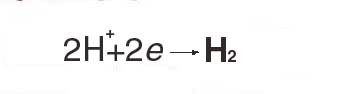
Электрохимические реакции протекают на поверхности металлических электродов, погруженных в раствор электролита. Электроны в обычных условиях не могут существовать в водном растворе в свободном состоянии, поэтому их и подводят к реагирующим веществам или отводят от них по электроду.
Электрохимические реакции очень важны в технике. В первой половине XIX в. почти единственными источниками электрического тока, с помощью которых делали многочисленные открытия в теории электричества, были электрохимические источники тока, или гальванические элементы.
2i.SU ©® 2015