Химия
Беседа о самом необыкновенном в мире веществе
Свойства воды
Почему вода — вода!
Этот вопрос совсем не так неразумен, как это может показаться. В самом деле, разве вода — это только та бесцветная жидкость, что налита в стакан? Океан, покрывающий почти всю нашу планету, всю нашу чудесную Землю, на которой миллионы лет назад зародилась жизнь, — это вода. Тучи, облака, туманы, несущие влагу всему живому на земной поверхности, — это ведь тоже вода. Бескрайние ледяные пустыни полярных областей, снеговые покровы, застилающие почти половину планеты,— и это вода. Прекрасно, невоспроизводимо бесконечное многообразие красок солнечного заката, его золотых и багряных переливов; торжественны и нежны краски небосвода при восходе солнца. Эта обычная и всегда необыкновенная симфония цвета обязана рассеянию и поглощению солнечного спектра водяными парами в атмосфере. Этот великий художник природы — вода.
Горные цепи сложены гигантскими толщами сотен различных горных пород, и геологи знают, что большинство из них создано величайшим строителем природы — водой. Непрерывно изменяется облик Земли. На месте, где возвышались высочайшие горы, расстилаются бескрайние равнины, их создает великий преобразователь — вода.
Безгранично многообразие жизни. Она всюду на нашей планете. Но жизнь есть только там, где есть вода.

Правильное кристаллическое строение льда выражается в изумительном изяществе снежинок.
Почему же одно из бесчисленных химических соединений, молекула которого состоит всего из 3 атомов, — простая окись водорода, самая обычная вода, занимает столь особое место в жизни природы? Чем объясняется такая исключительная роль воды?
Среди необозримого множества веществ вода с ее физико-химическими свойствами занимает совершенно особое, исключительное место. Это надо понимать буквально. Почти все физико-химические свойства воды — исключение в природе. Она действительно самое удивительное вещество на свете. Она удивительна не только многообразием изотопных форм молекулы и не только надеждами, которые связаны с ней как с неиссякаемым источником энергии будущего. Она удивительна своими самыми обычными свойствами. Простое химическое соединение с простейшей формулой Н2О заняло особое место на нашей чудесной планете благодаря изумительному сочетанию необычайных свойств.
Как построена молекула воды!
Как построена одна молекула воды, теперь известно очень точно. Она построена вот так:
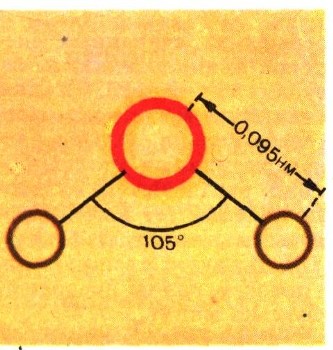
Хоро.шо изучено и измерено взаимное расположение ядер атомов водорода и кислорода и расстояние между ними. Оказалось, что молекула воды нелинейна. Вместе с электронными оболочками атомов молекулу воды, если на нее взглянуть «сбоку», можно было бы изобразить вот так :
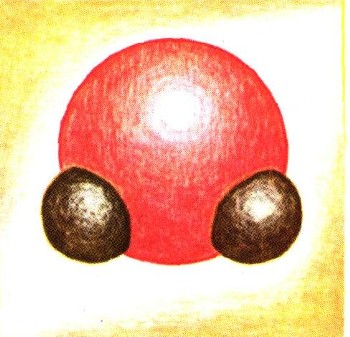
а если взглянуть «сверху» — со стороны атома кислорода, то так:

т. е. геометрически взаимное расположение зарядов в молекуле воды можно изобразить в виде простого тетраэдра.
Такое строение ведет к возникновению необычайно сильного взаимного притяжения молекул воды друг к другу: каждая молекула воды может образовать четыре одинаковые водородные связи с другими молекулами воды.

Все молекулы воды с любым изотопным составом построены совершенно одинаково.
Как построена молекула льда!
Никаких особых молекул льда нет. Молекулы воды благодаря своему замечательному строению соединены в куске льда друг с другом так, что каждая из них связана и окружена четырьмя другими молекулами. Это приводит к возникновению очень рыхлой структуры льда, в которой остается очень много свободного объема. Правильное кристаллическое строение льда выражается в изумительном изяществе снежинок и красоте морозных узоров на замерзших оконных стеклах.

Внизу (в круге) — схематическое расположение атомных ядер водорода и кислорода в молекулах воды, образовавших кристаллическую решетку льда. Вверху (в круге) — молекулы воды, образовавшие ледяной кристалл с сохранением масштабов электронных оболочек. Обратите внимание на рыхлую структуру льда.
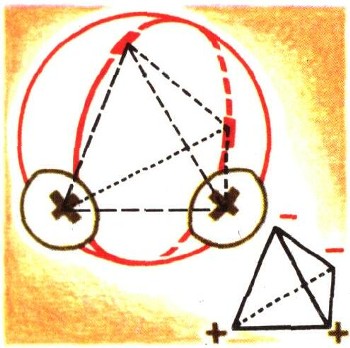
Положительные заряды в молекуле воды связаны с атомами водорода. Отрицательные заряды — это валентные электроны кислорода. Их взаимное расположение в молекуле воды можно изобразить в виде простого тетраэдра.
Как же все-таки построены молекулы воды в воде
К сожалению, этот очень важный вопрос изучен далеко не достаточно. Строение молекул в жидкой воде очень сложно. Когда лед плавится, его сетчатая структура частично сохраняется в образующейся воде. Молекулы в талой воде состоят из многих простых молекул — из агрегатов, сохраняющих свойства льда. При повышении температуры часть их распадается, их размеры становятся меньше.
Взаимное притяжение ведет к тому, что средний размер сложной молекулы в жидкой воде значительно превышает размеры одной молекулы воды. Такое необычайное молекулярное строение воды обусловливает ее необычайные физико-химические свойства.
При какой температуре вода должна кипеть!
Этот вопрос, конечно, странен. Ведь вода кипит при нормальном атмосферном давлении при ста градусах. Это знает каждый. Больше того, всем известно, что именно температура кипения воды при этих условиях и выбрана в качестве одной из опорных точек температурной шкалы Цельсия, условно обозначенной 100° С.
Однако вопрос поставлен иначе: при какой температуре вода должна кипеть? Ведь температуры кипения различных веществ не случайны. Они зависят от положения элементов, входящих в состав их молекул, в периодической системе Менделеева.
Если сравнивать между собой одинаковые по составу химические соединения различных элементов, принадлежащих к одной и той же группе таблицы Менделеева, то легко заметить, что чем меньше атомный номер элемента, чем меньше атомная масса, тем ниже температура кипения его соединений. Вода по химическому составу может быть названа гидридом кислорода. Н2Те, H2Se и H2S—химические аналоги воды.
Если проследить за температурами их кипения и сопоставить, как изменяются температуры кипения гидридов в других группах периодической системы, то можно довольно точно определить температуры кипения любого гидрида, так же как и любого другого соединения. Сам Менделеев таким способом предсказывал свойства химических соединений еще не открытых элементов.
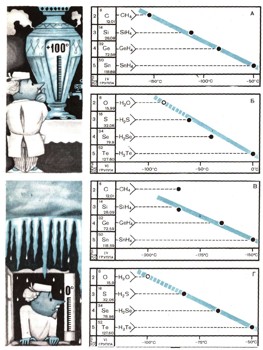
Свойства любого химического соединения зависят от природы образующих его элементов и, следовательно, от их положения в таблице Менделеева. На этих графиках приведены зависимости температур кипения и плавления водородных соединений элементов IV и VI групп периодической системы. Вода является поразительным исключением. Благодаря очень малому радиусу протона силы взаимодействия между ее молекулами столь велики, что разделить их очень трудно, поэтому вода кипит и плавится при аномально высоких температурах. Кроме воды в значительно меньшей степени аномальными свойствами обладают аммиак и фтористый водород. График А. Нормальная зависимость температуры кипения гидридов элементов IV группы от их места в таблице Менделеева. График В. Среди гидридов элементов VI группы вода обладает аномальными свойствами: должна была бы кипеть при минус 80 — минус 90° С, а кипит при плюс 100° С. График В. Нормальная зависимость температуры плавления гидридов элементов IV группы от их положения в таблице Менделеева. График Г. Среди гидридов элементов VI группы вода нарушает порядок: должна была бы плавиться при минус 100° С, а ледяные сосульки тают при 0° С.
Если же определить температуру кипения гидрида кислорода по положению его в периодической таблице, то окажется, что вода должна кипеть при —80° С. Следовательно, вода кипит приблизительно на сто восемьдесят градусов выше, чем должна кипеть. Температура кипения воды — это наиболее обычное ее свойство — оказывается необычайным и удивительным.
Попробуйте теперь представить себе, что наша вода потеряла вдруг способность образовывать сложные, ассоциированные молекулы. Тогда она, вероятно, должна была бы кипеть при той температуре, какая ей положена в соответствии с периодическим законом. Что бы тогда стало на нашей Земле? Океаны внезапно закипят. На Земле не останется ни одной капли воды, а на небе никогда не сможет больше появиться ни одного облачка... Ведь в атмосфере земного шара температура нигде не падает ниже минус 80 — минус 90° С.
При какой температуре вода замерзает!
Не правда ли, вопрос не менее странен, чем предыдущий? Ну кто же не знает, что вода замерзает при 0°С? Это вторая опорная точка термометра. Это самое обычное свойство воды. Но ведь и в этом случае можно спросить: при какой температуре вода должна замерзать в соответствии со своей химической природой? Оказывается, гидрид кислорода на основании его положения в таблице Менделеева должен был бы затвердевать при ста градусах ниже нуля.
Вода на самом деле очень удивительное вещество. Ее, пожалуй, даже можно назвать непослушным веществом. Она не подчиняется многим физико-химическим закономерностям, справедливым для других соединений, потому что взаимодействие ее молекул необычайно велико и требуется особенно интенсивное тепловое движение молекул, чтобы преодолеть дополнительное притяжение. Это и приводит к такому неожиданному и резкому повышению температур ее кипения и плавления.
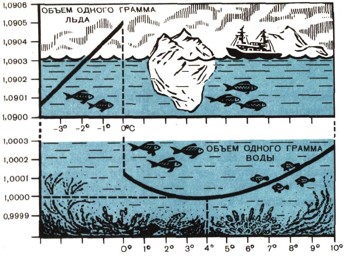
На графике показано, как изменяются с температурой объемы одного грамма льда и жидкой воды. Эти изменения очень малы, но они имеют большое значение для жизни природы. Такой странной и удивительной зависимостью плотности от температуры обладает только вода. Обратите внимание еще на Одно удивительное свойство воды — огромное расширение льда при замерзании. Оно так велико, что графически на одном чертеже представить изменение объема воды при замерзании невозможно. У тяжелой воды температурный ход изменения плотности аналогичен, но замерзает она при 3,8° С и наибольшей плотностью обладает при 11,6° С.
Попробуйте и на этот раз пофантазировать. Вдруг исчезнет способность молекул воды к ассоциации. Немедленно на всей нашей планете исчезают снега и льды. Нельзя кататься на коньках, негде бегать на лыжах; впрочем, и некому тогда было бы кататься и бегать.
Полагается ли воде быть на Земле жидкой или твердой!
Нет, не полагается. Из того, что температура плавления и кипения гидрида кислорода — его аномальное свойство, следует, что в условиях нашей Земли жидкое и твердое состояния его также аномалии. Нормальным должно было бы быть только газообразное состояние воды.
Невозможным жителям невозможного мира, в котором все свойства воды были бы «нормальны», пришлось бы строить специальные сложные машины, чтобы сжижать такую воду, подобно тому как это делаем мы, получая жидкий кислород. Самые обычные свойства воды оказываются необычайными и удивительными, если как следует с ними познакомиться и хорошо в них разобраться.
Сколько существует газообразных состояний воды!
Только одно — пар.
Сколько существует жидких состояний воды!
На такой вопрос не так просто ответить. Конечно, тоже одно — привычная нам всем жидкая вода. Но вода в жидком состоянии обладает такими необыкновенными свойствами, что приходится задуматься: правилен ли такой простой, казалось бы, не вызывающий никаких сомнений ответ? Вода — единственное в мире вещество, которое после плавления вначале сжимается, а затем по мере повышения температуры начинает расширяться. Примерно при 4° С у воды наибольшая плотность. Эту редкостную аномалию в свойствах воды объясняют тем, что в действительности жидкая вода представляет собой сложный раствор совершенно необычайного состава: это раствор воды в воде.
При плавлении льда сначала образуются крупные сложные молекулы воды. Они сохраняют остатки рыхлой кристаллической структуры льда и растворены в обычной низкомолекулярной воде. Поэтому сначала плотность воды низкая, но с повышением температуры эти большие молекулы разрушаются, и поэтому плотность воды растет, пока не начинает преобладать обычное тепловое расширение, при котором плотность воды снова падает. Если это верно, то возможно несколько состояний воды, только их никто не умеет разделить. И пока неизвестно, удастся ли когда-нибудь это сделать.
Такое необычайное свойство воды имеет огромное значение для жизни. В водоемах перед наступлением зимы постепенно охлаждающаяся вода опускается вниз, пока температура всего водоема не достигнет 4Р С. При дальнейшем охлаждении более холодная вода остается сверху, и всякое перемешивание прекращается. В результате создается необычайное положение: тонкий слой холодной воды становится как бы «теплым одеялом» для всех обитателей подводного мира. При 4° С они чувствуют себя явно неплохо.
Что должно быть легче — вода или лед!
Кто же этого не знает... Ведь лед плавает на воде. В океане плавают гигантские айсберги. Озера зимой покрыты плавающим сплошным слоем льда. Конечно, лед легче воды. Но почему «конечно»? Разве это так ясно? Наоборот, объем всех твердых тел при плавлении увеличивается, и они тонут в своем собственном расплаве. А вот лед плавает в воде. Это свойство воды — аномалия в природе, исключение, и притом совершенно замечательное исключение.

Попробуем вообразить, как выглядел бы мир, если бы вода обладала нормальными свойствами и лед был бы, как и полагается любому нормальному веществу, плотнее жидкой воды. Зимой намерзающий сверху, более плотный лед тонул бы, непрерывно опускаясь на дно водоема. Летом лед, защищенный толщей холодной воды, не мог бы растаять. Постепенно все озера, пруды, реки, ручьи промерзли бы нацело, превратившись в гигантские ледяные глыбы. Наконец, промерзли бы моря, а за ними и океаны. Наш прекрасный цветущий зеленый мир стал бы сплошной ледяной пустыней, кое-где покрытой тонким слоем талой воды. Чудесной аномалией обладает наше удивительное вещество.
Сколько существует льдов!
В природе на нашей Земле — один: обычный лед. Это самый прекрасный из всех минералов. Никакие алмазы не могут сравниться блеском и красотой со снежинками, искрящимися на солнце. Из этого голубовато-зеленого камня сложены на Земле не только горы и колоссальные ледники, им покрыты целые материки. Лед — горная порода с необычайными свойствами. Он твердый, но течет как жидкость, существуют огромные ледяные реки, медленно стекающие с гор. Лед необычайно прочен и долговечен — десятки тысячелетий хранит он в себе без изменений тела мамонтов, погибших в ледниковых трещинах. В своих лабораториях человек сумел открыть еще по крайней мере шесть различных, не менее удиви-
тельных льдов. В природе их найти нельзя. Они могут существовать только при очень высоких давлениях. Обычный лед сохраняется до давления 208 МПа (мегапаскалей), но при этом давлении он плавится при —22° С. Если давление выше чем 208 МПа, возникает плотный лед — лед-III. Он тяжелее воды и тонет в ней. При более низкой температуре и большем давлении — до 300 МПа — образуется еще более плотный лед-II. Давление сверх 500 МПа превращает лед в лед-V — этот лед можно нагреть до 0° С, и он не растает, хотя и находится под огромным давлением. При давлении около 2 ГПа (гигапаскалей) возникает лед-VI. Это буквально горячий лед — он выдерживает, не плавясь, температуру 80° С. Лед-VII, найденный при давлении 3 ГПа, пожалуй, можно назвать раскаленным льдом. Это самый плотный и тугоплавкий из известных льдов. Он плавится только при 190° С. Некоторые ученые подозревают, что существует еще неустойчивый лед-IV, быстро переходящий в лед-V. Наверно, человек, расширяя свои познания, сумеет в будущем найти еще не один вид льда.
Что нужно, чтобы лед растаял?
Очень много тепла. Гораздо больше, чем для плавления такого же количества любого другого вещества. Исключительно большое значение удельной теплоты плавления 335 Дж на 1 г льда — также аномальное свойство воды. При замерзании 1 кг воды такое же количество тепла снова выделяется. Когда наступает зима, образуется лед, выпадает снег и вода отдает обратно тепло, подогревает землю и воздух. Они противостоят холоду и смягчают переход к суровой зиме, к жестоким морозам. Именно благодаря этому замечательному свойству воды на нашей планете существуют осень и весна.
Что такое снежинки!
Сростки ледяных кристалликов, образовавшиеся при конденсации водяного пара в верхних слоях атмосферы, где очень низкая температура.
Почему же они такие красивые!
В кристаллической решетке льда есть плоскости, в которых атомы кислорода расположены так, что образуют правильные шестиугольники, как это видно на рисунке (стр. 409, вверху). Наверное, с этим и связана чаще всего встречающаяся шестилучевая форма изящных звездочек-снежинок. Изумительная красота и бесконечное разнообразие форм снежинок, их поразительная симметрия вдохновили многих ученых на исследования этой удивительной загадки природы. Были получены десятки тысяч фотографий снежинок в самых разнообразных условиях: и высоко в облаках, и у земли, и на крайнем севере, и на юге — всюду, где только может идти снег. Кроме огромного множества самых разнообразных форм гексагональной симметрии, встречаются и пластиночки, и столбики, и игольчатые формы. Сотни различных типов снежинок обнаружили ученые. Но если быть очень точными, то придется признать, что совершенно одинаковых снежинок не существует. В бесконечном многообразии каждая хоть чем-нибудь да отличается по форме и размеру.
Нет сомнения, что это зависит от бесконечной изменчивости условий образования и роста снежинок в атмосфере. С нежной красотой снежинки связано еще много неразгаданного в природе.
Сколько тепла нужно, чтобы нагреть воду!
Очень много. Больше, чем для нагревания равного количества любого другого вещества. Чтобы нагреть грамм воды на один градус, необходима одна калория, или 4,19 Дж. Это больше чем вдвое превышает теплоемкость любого химического соединения.
Вода — вещество, необычайное даже в самых обыденных для нас свойствах. Конечно, эта особенность воды имеет очень большое значение не только при варке обеда на кухне. Вода — это великий распределитель тепла на Земле. Нагретая Солнцем под экватором, она переносит тепло в Мировом океане гигантскими потоками морских течений в далекие полярные области, где жизнь возможна только благодаря этой удивительной особенности воды.
Как вода попадает в облака!
Очень просто. Солнце нагревает воду. Всюду, где она есть, — в луже, в пруду, в море, в океане. Вода поглощает в своем тонком верхнем слое почти всю энергию попадающих на нее солнечных лучей и испаряется. Молекулы воды исключительно просты в своем строении и вместе с тем необычайны, отличны от все других молекул. Они сильно притягиваются друг к другу благодаря силам межмолекулярного притяжения за счет дополнительных водородных связей. Солнцу приходится затрачивать очень много энергии, чтобы разделить молекулы воды, чтобы превратить ее в пар. Нет ни одного вещества, у которого бы удельная теплота испарения была бы больше, чем у воды. Вода — лучший теплоноситель. Ничто не может сравниться с ней. Ничто не может лучше работать в паровых турбинах электростанций, в цилиндрах паровых двигателей.
Вода — гигантский двигатель и в природе. Метеорологи подсчитали, что Солнце испаряет на Земле за одну минуту миллиард тонн воды. Каждую минуту миллиард тонн водяного пара вместе с восходящими потоками нагретого воздуха поднимается в верхние слои атмосферы. Каждый грамм водяного пара уносит с собой 537 калорий солнечной энергии.
На большой высоте, где давление мало, воздух расширяется, его температура сильно понижается и водяной пар конденсируется, снова превращаясь в воду — ее мельчайшие капельки образуют облака.
Энергия Солнца, поднятая с водяным паром вверх, неминуемо должна выделиться обратно, когда он превращается в облака. Эта энергия переходит в тепловую, нагревая воздух. Каждую минуту водяной пар отдает атмосфере Земли чудовищно огромное количество энергии: 2,2- 1018 Дж. Столько энергии за то же время могли бы выработать сорок миллионов электростанций, по миллиону киловатт каждая.
Это та энергия, которая переносит сотни миллиардов тонн воды по воздуху в облаках и орошает дождями всю поверхность Земли. Это та энергия, за счет которой дуют ветры, возникают бури, рождаются ураганы и штормы. А только один развившийся ураган выделяет энергию, эквивалентную энергии 30 тыс. атомных бомб.
Почему в море вода соленая!
Это, пожалуй, одно из самых важных следствий одного из самых удивительных свойств воды. В ее молекуле центры положительных и отрицательных зарядов сильно смещены относительно друг друга. Поэтому вода обладает исключительно высоким, аномальным значением диэлектрической проницаемости. Для воды е = 80, а для воздуха и вакуума е = 1. Это значит, что два любых разноименных заряда в воде взаимно притягиваются друг к другу с силой в 80 раз меньшей, чем в воздухе. Ведь по закону Кулона
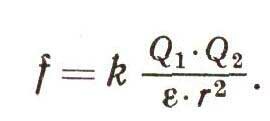
Но все межмолекулярные связи во всех телах, определяющие прочность тела, обусловлены взаимодействием между положительными зарядами атомных ядер и отрицательными электронами. На поверхности тела, погруженного в воду, силы, действующие между молекулами или атомами, ослабевают под влиянием воды почти в сотню раз. Если оставшаяся прочность связи между молекулами становится недостаточной, чтобы противостоять действию теплового движения, молекулы или атомы тела отрываются от его поверхности и переходят в воду. Тело начинает растворяться, распадаясь либо на отдельные молекулы, как сахар в стакане чаю, либо на заряженные частицы — ионы, как поваренная соль.
Именно благодаря аномально высокой диэлектрической проницаемости вода — один из сильнейших растворителей. Она способна растворить любую горную породу на земной поверхности. Медленно и неотвратимо она разрушает даже граниты, выщелачивая из них наиболее легко растворимые составные части. Нет в природе такой прочной породы, которая могла бы сопротивляться всемогущему разрушителю — воде.
Ручьи, речки и реки сносят растворенные водой примеси в океан. Вода океана испаряется и вновь возвращается на Землю, чтобы снова и снова продолжать свою вечную работу. А растворенные соли остаются в морях и океанах. Не думайте, что вода растворяет и сносит в море только то, что легко растворимо, и что в морской воде содержится только обычная соль, которая стоит на обеденном столе. Нет, морская вода содержит в себе почти все элементы, существующие в природе. В ней есть и магний, и кальций, и сера, и бром, и иод, и фтор. В меньшем количестве в ней найдены железо, медь, никель, олово, уран, кобальт, даже серебро и золото. Свыше 60 элементов нашли химики в морской воде. Наверное, будут найдены и все остальные. Больше всего в морской воде поваренной соли. Поэтому вода в море соленая.
А знаете ли вы, что кровь человека и животных близка по составу к морской воде? И что растения извлекают из земли питательные вещества в виде водного раствора? Если бы вода не обладала удивительным свойством — необычайно высокой диэлектрической проницаемостью, море не было бы соленым. Но это некому было бы заметить — не было бы на Земле жизни.
Распадаются ли в воде на ионы ее собственные молекулы!
Да, распадаются. Молекулы воды очень прочны, но все же очень небольшая часть их диссоциирует на ионы: Н2О = Н++OH-. При этом из каждого миллиарда молекул воды при обычной температуре диссоциированы всего лишь только 2 молекулы. Свободный протон Н+ — ядро атома водорода, — конечно, не может существовать в водной среде: ион водорода немедленно присоединяется к молекуле воды и образует ион гидроксония Н3О+.
А может ли быть вода без молекул воды!
Да, как будто бы может. Правда, такая вода еще пока не получена. Но ученые установили, что если воду нагревать все выше и выше, то диссоциация ее молекул на ионы будет все более возрастать. При очень высокой температуре должно наступить такое удивительное состояние воды, при котором в ней не останется ни одной молекулы воды, все они распадутся на ионы. Удалось рассчитать, что такое странное состояние воды должно наступить при температуре не ниже 900° С. Давление при этом должно быть не менее 15 ГПа (150000 атмосфер). Может быть, такая вода существует в недрах Земли. Интересно, какие у нее свойства?
Как вода образуется в воде из воды!
Конечно, проще всего предположить, что молекулы воды в воде образуются при взаимодействии протона — иона водорода с отрицательным ионом — гидроксилом. Так это и было написано во всех школьных учебниках мира. Потом химики стали считать, что молекулы воды образуются при взаимодействии гидроксила с ионом гидроксония: Н3О++ОН-=2Н2О.
Так как размеры иона гидроксония гораздо больше размеров «голого» протона — иона водорода Н+, то столкновения гидроксила с гидроксонием должны происходить чаще, чем с протоном, и скорость реакции должна быть выше. Можно даже теоретически рассчитать, определив размеры частиц, значение констант скоростей обеих реакций — и с протоном и с ионом гидроксония.
Однако опыт привел к неожиданному и удивительному результату: оказалось, что константа скорости реакции на самом деле имеет еще большее значение и молекулы воды в воде образуются и не из ионов водорода Н+, как учили школьные учебники, и не из попов гидроксония, как считают почти все химики, а из частиц гораздо больших размеров. Ученые думают теперь, что вода в воде образуется из больших ионов Н9О4+ и Н7О4-. Уравнение реакций образования воды в воде выглядит даже для глаза химика на самом деле совершенно удивительно: Н904+ + Н7О- = 8Н20
Почему вода «мокрая»!
Вода не очень «мокрая», если, считать, что этот шутливый вопрос относится к способности воды смачивать другие тела. Большинство жидкостей гораздо «мокрее» воды. Вода с трудом смачивает металлы, совершенно не смачивает жирные поверхности. Водой не намочишь парафин. Капли воды скатываются с поверхности многих полимерных материалов: тефлона, полиэтилена и др. Спирт же, например, или керосин очень хорошо смачивают почти любые тела. Это объясняется тем, что силы взаимодействия между молекулами воды так велики, что вода собирается в капли там, где другие жидкости растекаются.

Поверхностное натяжение воды столь велико, что по ней спокойно могут гулять довольно крупные водяные насекомые, вроде этих.
Это свойство воды причиняет много огорчений в обыденной жизни и в технике: загрязненные жиром или маслами руки водой не отмоешь. Из-за этого и было изобретено мыло. Химиками было синтезировано много специальных веществ — «смачивателей», чтобы воду сделать «мокрее».
А «сухой» вода может быть!
Оказывается, может. Недавно ученые сумели приготовить «сухую» воду. Для этого нужно к обычной воде добавить совсем немного тонко размельченного порошка несмачиваемой кремниевой кислоты. Вода сразу становится сухой и сыпучей. Ее можно пересыпать, перевозить в пакетах; даже на ощупь такая вода совсем не влажная, а сухая и холодная.
Какую форму имеет вода!
Хотя этот вопрос может показаться странным, но он задан совершенно правильно. Вода обладает собственной формой, как и любая другая жидкость. Ее форма — шар. Утверждение учебников, что вода принимает форму сосуда, а собственной не имеет, неверно. Ее собственная форма на Земле обычно искажена земным притяжением.
Но что воде свойственна форма шара, в этом очень легко убедиться — достаточно слетать на космическом корабле в космос и вытряхнуть там воду из бутылки. Можно увидеть это и на Земле: посмотрите на падающую каплю или выдуйте хороший мыльный пузырь. В этих случаях действие веса исключено и вода принимает собственную форму.
Можно ли бегать по поверхности воды!
Можно. Чтобы в этом убедиться, посмотрите летом на поверхность любого пруда или озера. По воде не только ходит, но и бегает немало живого и быстрого народца. Если учесть, что площадь опоры лапок у этих насекомых очень мала, то нетрудно понять, что, несмотря на их небольшую массу, а следовательно, и небольшой вес, поверхность воды выдерживает, не прорываясь, значительное давление.
Может ли вода течь вверх!
Да, может. Это происходит всегда и повсеместно. Сама поднимается вода вверх в почве, смачивая всю толщу земли от уровня грунтовых вод. Сама поднимается вода вверх по капиллярным сосудам дерева и помогает растению доставлять растворенные питательные вещества на большую высоту — от глубоко скрытых в земле корней к листьям и плодам. Сама движется вода вверх в порах промокательной бумаги, когда вам приходится высушивать кляксу, или в ткани полотенца, когда вытираете лицо. В очень тонких трубочках — капиллярах — вода может подняться на высоту до нескольких метров.
Чем это объясняется!
Еще одной замечательной способностью воды — ее исключительно большим поверхностным натяжением. Молекулы воды на ее поверхности испытывают действие сил межмолекулярного натяжения только с одной стороны, а у воды это взаимодействие аномально велико. Поэтому каждая молекула на ее поверхности втягивается внутрь жидкости. В результате возникает линейная сила, стягивающая поверхность жидкости. У воды она особенно велика: ее поверхностное натяжение составляет 73 мН/м (миллиньютона на метр).
Эта сила и придает мыльному пузырю, падающей капле и любому количеству жидкости в условиях невесомости форму шара. Она поддерживает бегающих по поверхности пруда жуков, лапки которых водой не смачиваются. Она поднимает воду в почве, стенки тонких пор и отверстий в ней, наоборот, хорошо смачиваются водой. Вряд ли вообще было возможно земледелие, если бы вода не обладала этой исключительной особенностью.
А может ли вода гореть!
Может. Вода неплохо горит в атмосфере свободного фтора.
Видел ли хоть кто-нибудь воду!
Этот вопрос может показаться нелепым. Однако если быть строгим и точным в ответах, то придется сказать, что нет — воду пока еще, наверное, никто не видел и не держал в руках. То, что налито в стакане и что мы по привычке называем водой, на самом деле всегда представляет собой раствор очень многих веществ в воде. В ней растворены газы: азот, кислород, аргон, углекислота — и все примеси, находящиеся в воздухе. В ней растворены, наверное, сотни, а может быть, и тысячи различных соединений почти всех элементов периодической системы. В ней взвешены мельчайшие нерастворимые частицы пыли. Это мы и называем чистой водой.
Много ученых работает над решением трудной проблемы получения абсолютно чистой воды. Но пока еще получить такую воду не удалось. Да и как это сделать: налитая в стакан вода растворяет стенки стакана, соприкасаясь с любым газом, она растворяет газ. Очень тщательно очищенная и освобожденная от газов вода приобретает совершенно необычайные свойства: ее можно перегреть на десятки градусов выше точки кипения — она не закипит, ее можно очень сильно переохладить — она не замерзнет.
Все ли свойства воды понятны ученым!
Конечно, нет! Вода — загадочное вещество. До сих пор ученые не могут еще понять и объяснить очень многие ее свойства. Непонятно, например, почему вода не только изменяет некоторые свойства при воздействии на нее магнитного поля, но и надолго сохраняет эти изменения. В такой воде иначе идут реакции осаждения. Многие соли из обычной воды выпадают при ее испарении в форме плотного осадка, образуя накипь (посмотрите в чайник). «Намагниченная вода» накипи не образует. Почему это так — никто не знает. Но то, что явление это еще не понято и пока не объяснено, нисколько не мешает инженерам с успехом применять его в технике для борьбы с накипью в паровых котлах тепловых электростанций.
Недавно было обнаружено новое загадочное явление. Оказалось, что вода на Земле изменяет свою природу в зависимости от того, что происходит на Солнце и в космосе. Было замечено, что космические причины влияют на характер протекания в воде некоторых химических процессов, например на скорость появления осадков. Почему — неизвестно.
Многие наблюдения и факты говорят о том, что талая вода обладает особыми свойствами — она более благоприятна для развития живых организмов. Почему — тоже неизвестно. Можно не сомневаться, что все подобные загадки будут успешно разрешены наукой. Будет открыто еще немало новых, более удивительных загадочных свойств воды — самого необыкновенного вещества в мире.
Все ли свойства воды уже перечислены в этой статье!
Нет, к сожалению, далеко не все. Не хватило места даже для наиболее интересных. Но тот, кто захочет подробно познакомиться со всеми свойствами воды, которые уже изучены, сможет это сделать самостоятельно. Для этого ему нужно будет прочесть во всех научных библиотеках мира все вышедшие журналы и книги, где напечатаны научные работы по химии, физике, биологии, физиологии, биохимии, биофизике, геологии, геохимии. Придется изучить и многие работы по астрономии и астрофизике. (Интересно, есть ли вода на планетах, в межзвездном пространстве, в далеких галактиках? И как ее там ищут астрономы?) Надо будет изучить работы по зоологии и ботанике (ни животные, ни растения без воды жить не могут). Рыбы и микроорганизмы живут в воде — придется читать работы по ихтиологии и микробиологии.
Само собой разумеется, что нельзя пропустить книги по гидрологии, океанологии, лимнологии (это очень интересная наука об озерах), необходимо также изучить работы ученых по теории рек, их образованию и жизни, тщательно проработать все, что известно по гляциологии (это очень важная наука о свойствах льда — она помогает строить большие города на далеком Севере), по спелеологии (ведь пещеры в недрах Земли созданы водой, и это тоже ее свойство).
Без термодинамики нельзя понять роль воды в энергетике (ведь большинство тепловых электростанций работают на водяном паре, а гидростанции — на воде). Придется изучить и ядерную физику (зачем атомной энергетике нужна тяжелая вода). Есть еще очень трудная наука — гидравлика. Придется изучить ряд разделов электротехники — без этой науки нельзя усвоить электрохимию, большинство процессов которой протекает в водных растворах. Где и какие реки, моря и океаны расположены на Земле, рассказано в работах по географии. Совершенно особые свойства воды изучает навигация — наука о кораблевождении и теория кораблестроения.
Очень много интересного о воде можно узнать из книг по метеорологии — науке, которая изучает, почему рождаются тучи и идет из них дождь. Нельзя оставить без внимания научные работы по медицине — и в человеке все жизненные процессы протекают в водной среде. Может быть, вы думаете, что можно пропустить сочинения по истории, по экономике? Нет, их развитие определилось на нашей планете водными путями сообщения. Наверное, можно назвать, если хорошенько подумать, еще много других отраслей знаний, в которых изучаются свойства воды. Попробуйте подумать сами.
Все ли уже известно о воде!
Совсем еще недавно, немного лет назад, химики были уверены, что состав воды им хорошо известен. Но однажды одному из них пришлось измерить плотность остатка воды после электролиза. Он был удивлен: плотность оказалась на несколько стотысячных долей выше нормальной. В науке нет ничего незначительного. Эта ничтожная разница потребовала объяснения. В результате ученые открыли много новых больших тайн природы. Они узнали, что вода очень сложна. Были найдены новые изотопные формы воды. Добыта из обычной тяжелая вода; оказалось, что она совершенно необходима для энергетики будущего. Теперь во всех странах мира физики упорно и неустанно работают над решением этой великой задачи. А началось, все с простого измерения самой обычной, будничной и неинтересной величины — плотность воды измерена точнее на лишний десятичный знак.
Каждое новое, более точное измерение, каждый новый верный расчет, новое наблюдение не только повышают уверенность в знании и надежности уже добытого и известного, но и раздвигают границы неведомого и еще не познанного, прокладывают к ним новые пути.
Нет предела человеческому разуму, нет предела его возможности; и то, что мы теперь так много знаем о природе и свойствах воды — поистине самого удивительного в мире вещества, — открывает перед нами, перед теми, кто читает сейчас эту книгу, еще большие, неограниченные возможности. И кто может сказать, что вы еще узнаете, что откроете нового, еще более необычайного. Умейте только видеть и удивляться. Вода, как и все в мире, неисчерпаема.
Так льется вода
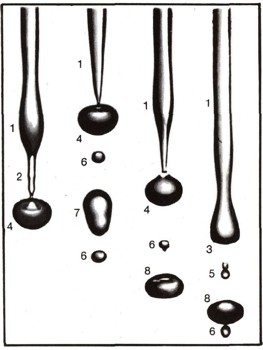
На этих снимках сфотографирован конец очень тонкой водяной струи. На поверхности струи возникают волнообразные упругие колебания (1). Они усиливаются, и образуется тонкая перетяжка (2), она разрывается. Утолщение струи (3), находившееся перед перетяжкой, превращается в каплю (4), а то, что было перетяжкой, оттягивается (5) и становится маленькой капелькой (б). Она названа шариком Плато, по имени бельгийского физика, который сумел предсказать существование этой капельки задолго до того, как ученые смогли ее рассмотреть. Под действием поверхностного натяжения капля колеблется. Она то вытягивается (7), то, снова расширяясь, сплющивается (8). Ее колебания хорошо изучены. Они в свое время помогли физикам разгадать тайну деления атомного ядра. Распад струи жидкости на капли имеет очень большое значение в технике, поэтому его тщательно изучают. Механизм образования капель влияет на эффективность использования горючего при впрыскивании его в двигатель внутреннего сгорания. От распада струи зависит и мощность двигателя. (Снимки сделаны выдержкой в одну миллионную долю секунды. Они увеличены в 10 раз.)
Капля воды, упавшая в воду
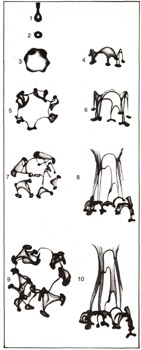
Это изящное и загадочное явление каждый из нас может наблюдать. Для этого нужно очень осторожно уронить подкрашенную каплю с высоты 1—2 см в прозрачную банку с водой, которая перед опытом простояла несколько часов вдали от источника тепла, и в ней прекратилось конвекционное движение. На этих фотографиях, сделанных специально для Детской энциклопедии, показано, что происходит с каплей. Капля (1), упав с кончика пипетки в воду, превращается в вихревое кольцо (2). Оно расширяется, и в нем возникают утолщения (3). Постепенно они развиваются во вторичные вихревые колечки (4, 5, 6). Процесс повторяется, и число колечек быстро растет (7, 8, 9, 10). В такую сложную систему вихревых потоков капля превращается всего за несколько минут. Слева — процесс снят сверху, справа — сбоку. Это удивительное явление еще почти не известно и не изучено. Может быть, кто-либо из читателей исследует его и откроет законы, которые им управляют? Кто знает, к каким последствиям это приведет в будущем.
Откуда на Земле взялась вода!
Вечно по всем направлениям Вселенную пронизывают потоки космических лучей— потоки частиц с огромной энергией. Больше всего в них протонов — ядер атомов водорода. В своем движении в космосе наша планета непрерывно подвергается «протонному обстрелу». Пронизывая верхние слои земной атмосферы, протоны захватывают электроны, превращаются в атомы водорода и немедленно вступают в реакцию с кислородом, образуя воду. Расчет показывает, что ежегодно почти полторы тонны такой «космической» воды рождается в стратосфере. На большой высоте при низкой температуре упругость водяного пара очень мала и молекулы воды, постепенно накапливаясь, конденсируются на частицах космической пыли, образуя таинственные серебристые облака. Ученые предполагают, что они состоят из мельчайших ледяных кристалликов, возникших из такой космической воды. Подсчет показал, что воды, появившейся таким образом на Земле за всю ее историю, как раз хватило бы, чтобы родились все океаны нашей планеты. Значит, вода пришла на Землю из космоса? Но... Геохимики не считают воду небесной гостьей. Они убеждены, что у нее земное происхождение. Породы, слагающие земную мантию, которая лежит между центральным ядром Земли и земной корой, под влиянием накапливающегося тепла радиоактивного распада изотопов местами расплавлялись. Из них выделялись летучие составные части: азот, хлор, соединения углерода, серы, больше всего выделялось водяных паров. Сколько же воды могли выбросить при извержениях все вулканы за все время существования нашей планеты? Ученые подсчитали, и это. Оказалось, что такой изверженной «геологической» воды тоже как раз хватило бы, чтобы заполнить все океаны. Интересно все-таки было бы знать: откуда же на Земле взялась вода?
Ответ (загадку найдите сами)
Этот изящный венец не корона средневекового владыки, как может показаться на первый взгляд. Все гораздо проще... и интереснее. Фотографу удалось запечатлеть процесс падения капли молока на поверхность жидкости (тоже молока). Что же происходит? Стенки углубления в жидкости, возникшего при прохождении сквозь ее поверхность капли, сначала спадаются. Энергия жидкости кумулируется (накапливается) в центре. Из середины буквально выстреливает жидкая струя. Ее уже не видно на снимке. От нее осталась только высоко поднявшаяся вверх крупная капля. Снова опустившаяся вниз жидкость, обладающая большой энергией, выбрасывается по краям в виде конуса из тонкой жидкой пленки, распадающейся затем на тонкие струйки. Каждая из струек, в свою очередь, распадается на капли. Их на снимке видно очень хорошо. Не следует думать, что это просто интересные пустяки, не имеющие значения. В природе имеет значение все. Такого рода процессы, как этот, привели к созданию кумулятивных снарядов, пробивающих самую прочную броню.
2i.SU ©® 2015