Химия
Беседа о самом необыкновенном в мире веществе
Что такое вода
Такой вопрос может показаться не только странным, но и немного невежливым. Кто же этого может не знать? Всякий знает, что вода — это соединение водорода и кислорода. Вот ее всем известная формула Н2О. С водой очень хорошо знаком каждый, кто умывается по утрам, пьет чай, умеет плавать, любит бегать под дождем, не боясь промокнуть, катается на коньках и ходит на лыжах.
Сколько существует различных водородов!

В природе существует три, различных водорода — три его изотопа. Самый легкий — 1Н. Химики его часто называют протием. Водород в обычной воде почти нацело состоит из протия. Кроме него во всякой воде есть тяжелый водород — дейтерий 2Н, его чаще в химии обозначают символом D. Дейтерия в воде очень мало. На каждые 6700 атомов протия в среднем приходится только один атом дейтерия. Кроме протия и дейтерия существует еще сверхтяжелый водород 3Н. Его обычно называют тритием к обозначают символом Т. Тритий радиоактивен, период его полураспада немного больше 12 лет. Он непрерывно образуется в стратосфере под действием космического излучения. Количество трития на нашей Земле исчезающе мало — меньше одного килограмма на всем земном шаре, но, несмотря на это, его можно обнаружить повсюду, в любой капле воды. Физики научились получать тритий искусственно в ядерных реакторах. Ученые заподозрили, что возможно существование четвертого изотопа водорода 4Н и даже пятого 5Н. Эти изотопы тоже должны быть радиоактивными.
Сколько на свете кислородов!
В природе найдены три различных изотопа кислорода. Больше всего легкого кислорода 16О, значительно меньше тяжелого 18О и совсем мало кислорода 17О. В кислороде воздуха, которым мы дышим, на каждые десять атомов 17О приходится 55 атомов 18О и более 26000 атомов изотопа кислорода 16О.

Физики сумели создать в своих ускорителях и реакторах еще пять радиоактивных изотопов кислорода: 13О, ИО, 15О, 19О и 20О. Все они живут очень недолго и через несколько минут распадаются, превращаясь в изотопы других элементов.
Сколько может быть различных вод!
Если подсчитать все возможные различные соединения с общей формулой Н2О, то результат покажется неожиданным: всего могут существовать сорок восемь разных вод. Из них тридцать девять вод будут радиоактивными, но и стабильных, устойчивых вод тоже будет немало — девять:
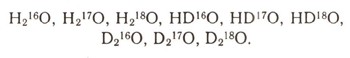
Если же окончательно подтвердится сообщение о том, что существует еще два .сверхтяжелых изотопа водорода 4Н и 5Н, то будут возможны уже сто двадцать различных вод. Но и это еще не все. Советские физики совсем недавно (1970) на большом ускорителе многозарядных ионов создали совершенно удивительный кислород — сверхтяжелый изотоп 24О. В его ядре огромный избыток нейтронов, и оно очень неустойчиво. Если принять во внимание и этот новый изотоп кислорода, то тогда различных вод можно будет насчитать уже сто тридцать пять!
Тяжелая вода кипит при более высокой температуре, чем обычна; вода... ...и замерзает при более высокой температуре.
Подсчитайте сами, сколько различных вод, молекулы которых содержат тритий, может образовываться на границе с космосом и постепенно вместе с дождями выпадать на землю. Попробуйте сосчитать также, сколько различных радиоактивных вод возникает в воде, охлаждающей атомный реактор.
Где бы в мире ни зачерпнуть стакан воды, в нем всегда окажется смесь различных молекул, неодинаковых по изотопному составу. Конечно, вероятность образования молекул с разным изотопным составом далеко не одинакова. Молекулы, содержащие сразу два или три редко встречающихся изотопных атома, будут возникать так редко и их будет так мало, что, по мнению физиков, их пока можно не принимать во внимание.
Что же такое обыкновенная вода!
Такой воды в мире нет. Нигде нет обыкновенной воды. Она всегда необыкновенная. Даже по изотопному составу вода в природе всегда различна. Он зависит от истории воды — от того, что с ней происходило в бесконечном многообразии ее кругово-рота в природе. При испарении вода обогащается протием, и вода дождя поэтому отлична от воды озера.
Вода реки непохожа на морскую воду. В закрытых озерах вода содержит больше дейтерия, чем вода горных ручьев. В каждом источнике свой изотопный состав воды. Когда зимой вода в озере замерзает, никто из тех, кто катается на коньках, и не подозревает, что изотопный состав льда изменился: в нем уменьшилось содержание тяжелого водорода, но зато повысилось содержание тяжелого кислорода. Поэтому вода из растаявшего льда уже другая и отличается от той воды, из которой лед был получен.
Если воду разложить химически и сжечь добытый из нее водород, то получится снова вода, но совсем другая, потому что в воздухе изотопный состав кислорода отличается от среднего изотопного состава кислорода воды. Но зато, в отличие от воды, изотопный состав воздуха один и тот же на всем земном шаре. Вода в природе не имеет постоянного изотопного состава, она вечно меняется, и только поэтому нельзя сказать, что где-то есть какая-то обыкновенная вода.
Что такое легкая вода!
Это та самая вода, формулу которой знают все школьники — Н216О. Но такой воды в природе нет. Такую воду с огромным трудом приготовили ученые. Она им понадобилась для точного измерения свойств воды, и в первую очередь для измерения ее плотности. Пока такая вода существует только в нескольких крупнейших лабораториях мира, где изучают свойства различных изотопных соединений.
Что такое тяжелая вода!
И этой воды в природе нет. Строго говоря, нужно было бы называть тяжелой воду, состоящую только из одних тяжелых изотопов водорода и кислорода D218O, но такой воды нет даже и в лабораториях ученых. Пока она еще никому не нужна, и незачем ее готовить. Конечно, если тяжелая вода понадобится науке или технике, ученые сумеют найти способ, как ее получить: и дейтерия и тяжелого кислорода в природной воде сколько угодно.
В науке и ядерной технике принято условно называть тяжелой водой тяжеловодородную воду. Она содержит только дейтерий, в ней совсем нет обычного легкого изотопа водорода. Изотопный состав по кислороду в этой воде соответствует составу кислорода воздуха.
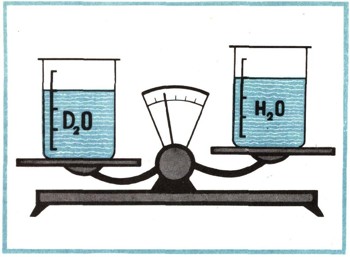
Тяжелая вода потому и тяжелая, что тяжелее обычной. Ее плотность 1,104.
Еще совсем недавно никто в мире и не подозревал, что такая вода существует, а теперь во многих странах мира работают гигантские заводы, перерабатывающие миллионы тонн воды, чтобы извлечь из нее дейтерий и получить чистую тяжелую воду.
Бывает ли полутяжелая вода!
Полутяжелой водой можно назвать воду со смешанными молекулами состава HDO. Она есть во всякой природной воде, но получить ее в чистом виде невозможно, потому что в воде всегда протекают реакции изотопного обмена. Атомы изотопов водорода очень подвижны и непрерывно переходят из одной молекулы воды в другую. Приготовить воду, средний состав которой будет соответствовать формуле полутяжелой воды, нетрудно. Но благодаря реакции обмена
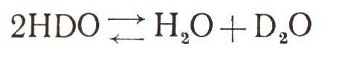
она будет представлять собой смесь молекул с разным изотопным составом : Н2О, HDO, D2O.
Что такое «нулевая» вода!
«Нулевая» вода состоит из чистого легкого водорода и кислорода воздуха. Эту воду физико-химики выбрали в качестве эталона: у нее очень постоянный состав. Ее не так уж трудно получать, и с ней удобно сравнивать воду неизвестного состава: определив разницу в плотности, легко найти содержание дейтерия.
А может быть, есть еще какая-нибудь вода!
Кроме всех перечисленных вод еще существует тяжелокислородная вода Н218О. Получать ее из природной воды очень сложно и трудно. До сих пор эту воду в чистом виде еще, пожалуй, никто не сумел приготовить. Тяжелокислородная вода очень нужна для исследования многих биологических и химических процессов, поэтому довольно концентрированные растворы этой воды в воде обычной получают теперь на заводах.
А радиоактивная вода существует!
Да. Физики научились получать тритиевую воду искусственным путем в атомных реакторах. Из-за сильной радиоактивности эта вода очень опасна. Пока такая вода нужна только ученым.
Больше еще никаких вод не получено!
Больше нет. Просто потому, что все остальные возможные воды пока еще никому не нужны. Если понадобятся и они, без сомнения, наука найдет способ получать любую из них.
Много ли разных вод содержится в воде!
В какой воде? В той, что льется из водопроводного крана, куда она пришла из реки, тяжелой воды D216O около 150 г на тонну, а тяжелокислородной (Н217О и Н218О вместе) почти 1800 г на тонну воды. А в воде из Тихого океана тяжелой воды почти 165 г на тонну. В тонне льда одного из больших ледников Кавказа тяжелой воды на 7 г больше, чем в речной воде, а тяжелокислородной воды столько же. Но зато в воде ручейков, бегущих по этому леднику, D216O оказалось меньше на 7 г, а Н218О — на 23 г больше, чем в речной.
Тритиевая вода Т216О выпадает на землю вместе с осадками, но ее очень мало — всего лишь 1 г на 1012 т (биллион тонн) дождевой воды. В океанской воде ее еще меньше. Строго говоря, вода всегда и всюду разная. Даже в снеге, выпадающем в разные дни, разный изотопный состав. Конечно, отличие невелико. Всего 1—2 г на тонну. Только, пожалуй, очень трудно сказать — мало это или много.
В чем же различие между легкой, природной и тяжелой водой!
Ответ на этот вопрос будет зависеть от того, кому он задан. Каждый из нас не сомневается, что с водой-то он знаком хорошо. Если каждому из нас показать три стакана с обычной, тяжелой и легкой водой, то каждый из нас даст совершенно четкий и определенный ответ: во всех трех сосудах простая чистая вода. Она одинаково прозрачна и бесцветна. Ни на 'вкус, ни на запах нельзя найти между ними никакой разницы. И это будет верно. Это все — вода.
Химик на этот вопрос ответит почти так же: между ними нет почти никакой разницы. Все их химические свойства почти неразличимы: в каждой из этих вод натрий будет одинаково выделять водород, каждая из них при электролизе будет одинаково разлагаться, все их химические свойства будут почти совпадать. Это и понятно: ведь химический состав у них одинаков. Это вода.
Физик не согласится. Он укажет на заметную разницу в их физических свойствах: и кипят и замерзают они при различных температурах, плотность у них разная, а давление их пара тоже немного различно. Правда, все эти различия малы. Изменения в изотопном составе очень мало влияют на физические свойства вещества.
Биолог, пожалуй, встанет в тупик и не сразу сумеет найти ответ. Ему нужно будет над вопросом о различии между водой с разным изотопным составом еще немало поработать. Совсем недавно все считали, что в тяжелой воде живые существа не могут жить. Ее даже мертвой водой называли. Но оказалось, что если очень медленно, осторожно и постепенно заменять протий в воде, где живут некоторые микроорганизмы, на дейтерий, то можно их приучить к тяжелой воде и они будут в ней неплохо жить и развиваться, но обычная вода станет для них вредной.
Кому же нужна тяжелая вода!
Человечеству! Оно уже стоит у порога, за которым ждет его страшная угроза энергетического голода. И вся надежда связана с тем, что будет решена проблема, как использовать для энергетики тяжелую воду.
Зачем нужна тяжелая вода теперь!
Все, что мы до сих пор говорили, касалось тех свойств, которые зависят от строения атомов, от их порядкового номера, от числа и расположения электрических зарядов в атомных ядрах и электронов в молекуле. Только это и определяет химическое поведение вещества. Строение молекулы, не зависит от массы атомного ядра. Поэтому одинаковые молекулы с разным изотопным составом химически почти неразличимы.
Но сходство в свойствах изотопных соединений прекращается, когда вопрос касается кинетических и ядерных характеристик. Молекула, содержащая тяжелый изотопный атом, при той же температуре движется с меньшей скоростью, при столкновении таких частиц иначе протекает обмен кинетической энергией. А самое главное — это то, что изменяется способность вступать в ядерные превращения.
Вот эти-то свойства резко отличают тяжелую воду от любой другой воды с иным изотопным составом: ведь в ее состав входит тяжелый водород. В наши дни тяжелая вода успешно применяется в атомной энергетике для замедления нейтронов в ядерных реакторах.
Роль замедлителя в атомном котле очень важна. Когда ядро урана-235 распадается на два атомных ядра-осколка, из него одновременно вылетают два или три нейтрона. Скорость их огромна, она превышает 20 000 км/с. Эти быстрые нейтроны не могут сами вызвать новый распад в других атомах урана. Они пролетят мимо них с такой быстротой, что просто не успеют прореагировать. Нейтроны нужно замедлить примерно до 2,2 км/с, так, чтобы они пришли в равновесие с тепловым движением окружающих молекул. При этом энергия нейтронов должна уменьшиться почти в 60 млн. раз. Далеко не всякое вещество пригодно в качестве замедлителя. Выбор очень ограничен. Во-первых, оно не должно поглощать нейтроны, вступая само в ядерные реакции, а во-вторых, оно должно состоять обязательно из легких элементов с малыми массовыми числами. При соударении с тяжелым ядром скорость нейтрона почти не изменяется, точно так же как почти не изменяется скорость мяча, отскакивающего при ударе о стенку.
Самым лучшим замедлителем мог бы быть легкий водород, но он заметно поглощает нейтроны. Тяжелый водород их почти не поглощает. Нейтрону, попавшему в тяжелую воду, достаточно всего 25 раз столкнуться с тяжелым водородом, чтобы потерять свою высокую энергию и приобрести способность взаимодействовать с ураном. Неплохой замедлитель — углерод в форме графита, но нейтрону в нем приходится испытывать около 110 столкновений, чтобы утратить начальную скорость.
Использование тяжелой воды в качестве замедлителя позволяет конструкторам создавать очень эффективные, а главное, легкие и компактные атомные энергетические установки, особенно для их применения на транспорте.
Зачем еще нужна тяжелая вода!
Чтобы исследовать механизм многих химических, физических и биологических процессов. Это, конечно, скромное, но очень важное применение тяжелой воды. Наверное, нет ни одного природного процесса, в котором не принимала бы участие вода или водород. Атомы тяжелого водорода наиболее важные меченые атомы. Их, как разведчиков в бой, направляют химики в исследуемую реакцию, чтобы проследить за ее ходом. В наши дни уже возникла и быстро развивается самостоятельная область науки — химия изотопного обмена. Наиболее важная ее задача — изучать с помощью дейтерия механизм химических реакций при получении органических соединений и исследовать их строение.
Почему же человечеству будет нужна именно тяжелая вода!
Чтобы ответить на этот вопрос, нельзя обойтись без самого замечательного языка — без языка цифр и формул. Он понятен всем по-настоящему грамотным людям, в какой бы стране они ни жили и на каком бы языке ни разговаривали. Для химиков теперь очень точно измерены массы всех изотопных атомов. Вот некоторые значения этих масс:
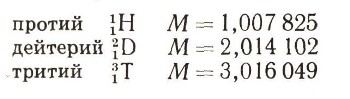
Физики сумели установить возможность ядерных реакций между легкими атомами, в том числе возможность реакций между атомами дейтерия:
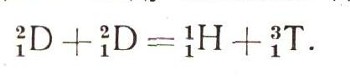
К такой реакции неприменим закон сохранения массы, каким представляла его старая химия, — в результате реакции получается недостача: 2 X 2,014 102 — 1,007 825 — 3,016 049 = 0,004 330 г.
Это немалая недостача, она означает, что если бы удалось найти условия, при которых может протекать реакция между двумя молями тяжелого водорода, то, согласно уравнению Эйнштейна Е = дельта mс2, можно было бы получить энергию:
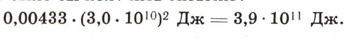
Это немалая энергия. В наше время, чтобы получить такую энергию, приходится сжигать в топках котлов ни много ни мало 13,5 т первосортного угля. А ведь его еще нужно добыть и доставить к топке. Между тем в соответствии с уравнением ядерной реакции такую энергию можно получить при затрате всего лишь 2 молей атомов дейтерия, которые содержатся в 1 моле тяжелой воды. А тяжелая вода есть в любой природной воде. Следовательно, простой воды потребуется
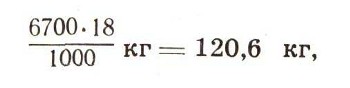
или приблизительно 120 л. Значит, из одного литра обычной воды можно добыть больше энергии, чем можно получить ее из ста килограммов высококачественного угля. А запасы воды на нашей Земле неисчерпаемы.
Что же мешает получать энергию из воды!
Такая возможность пока что кажется фантастической, но она вполне реальна. На пути к ее осуществлению наука преодолела немало трудностей. Уже решена сложнейшая проблема, как извлекать тяжелую воду из природной. Теоретически уже исследованы и рассчитаны условия, при которых возможны ядерные реакции между легкими атомами.
Но, к сожалению, исследователи встретили много трудностей. Насколько они серьезны, может показать прямой расчет: чтобы два атома могли вступить в ядерную реакцию, их ядра должны столкнуться, т. е. сблизиться до расстояния, начиная с которого межъядерные силы уже могут преодолеть электростатическое отталкивание — примерно до 10-14 м.
Но ядра атомов защищены, как броней, своими электронными оболочками. Эти оболочки простираются на расстояние в десятки тысяч раз большее. А самое главное — ядра заряжены и отталкиваются друг от друга, как и все одноименно заряженные тела. Энергию, необходимую для того, чтобы преодолеть их взаимное отталкивание, рассчитать нетрудно. Из закона Кулона следует, что потенциальная энергия (в джоулях) двух ядер, сблизившихся на расстояние 10-14 м, должна быть равна:
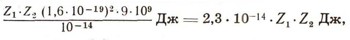
если между собой сталкиваются элементы с атомными номерами Z1 и Z2. Конечно, мир атомных величин не очень привычен и нагляден, и трудно сразу представить себе, какова же эта энергия — мала или не очень мала. Но легко сообразить, с какой скоростью должны сталкиваться атомы, чтобы преодолеть потенциальную энергию электростатического отталкивания. Они должны обладать не меньшей кинетической энергией или по крайней мере равной. Следовательно, можно написать :
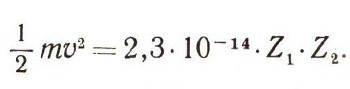
Массу одного атома можно найти из значения атомной массы, зная, сколько атомов содержится в 1 моле:
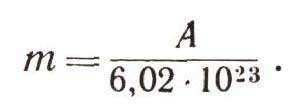
Можно найти и скорость, с которой должны столкнуться атомы, чтобы могла начаться ядерная реакция:
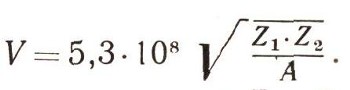
У дейтерия атомный номер Z=l. Масса изотопа А = 2, следовательно, скорость атомов должна быть: V = 3,8*106 м/с, или 3800 км/с. При обычной температуре физикам известна средняя скорость теплового движения у атомов дейтерия, она равна всего лишь 1,9 км/с. При комнатной температуре, равной примерно 293 К, кинетическая энергия молекул возрастает пропорционально термодинамической температуре, или, что то же самое, пропорционально квадрату скорости. Следовательно, чтобы средняя скорость молекул дейтерия была достаточной для реакции между ядрами, нужно нагреть тяжелый водород до температуры:
Итак, сталкиваться и реагировать между собой могут только ядра дейтерия, «нагретые» до температуры свыше миллиарда Кельвинов. Вот в этом-то и заключается довольно серьезное затруднение для подлинных героев науки — физиков, посвятивших свою жизнь труднейшей и величественнейшей из проблем — обеспечить энергией будущие поколения.
Быть может, тяжелую воду можно чем-нибудь заменить?
Ничем. Тяжелая вода как источник тяжелого водорода для термоядерных реакций с целью получения энергии, по-видимому, незаменима. Это следует из того, что необходимая для начала реакции температура очень сильно возрастает по мере увеличения атомного номера элемента. В самом деле, попробуйте сами подсчитать, какой температуре будет соответствовать кинетическая энергия частиц, способных преодолеть электростатическое отталкивание ядер атомов бериллия или кремния. Часть дейтерия можно заменить на тритий, но этого изотопа в природе почти нет, а получать его очень сложно и дорого.
Неужели же это все-таки возможно!
Очень трудно, но возможно. Во-первых, природа и физика идут навстречу исследователям: чтобы началась реакция, не нужно, чтобы весь газ был нагрет до такой немыслимо чудовищной температуры. Достаточно, если отдельные атомы будут обладать в нем столь высокой энергией.
Во всяком газе при любой температуре есть частицы с разными скоростями, от очень малых до очень больших. Благодаря этому реакция между атомами дейтерия будет идти с достаточной скоростью даже и при температуре в несколько раз меньшей чем 109 К. Это намного облегчает задачу. Кроме того, существует так называемый туннельный эффект, благодаря которому всегда есть некоторая вероятность, что реакция между ядрами все же может произойти, даже если их кинетическая энергия будет несколько ниже, чем необходимо для преодоления электростатического отталкивания.
Поэтому для начала термоядерного процесса между ядрами тяжелого водорода оказывается вполне достаточной температура всего только в триста миллионов Кельвинов (!). Если же вести реакцию между дейтерием и тритием, то будет достаточно и сорока миллионов Кельвинов.
Как же это будет сделано!
Это уже сделано. Физики осуществили реакцию термоядерного взрыва, в которой температура, необходимая для начала ядерного синтеза более тяжелых элементов из легких ядер, достигается взрывом атомного заряда — запалом.
Но очень, очень много осталось еще сделать. Ведь нужен человечеству не взрыв, а управляемая реакция — источник энергии для промышленности, для транспорта, для всего, что будет необходимо обществу будущего. Нужна термоядерная «топка» — «топка» с температурой в сотни миллионов кельви-нов.
Можно быть уверенным, что эта еще более фантастическая задача будет решена. Физики в нашей стране первыми нашли поистине совершенно удивительный путь к созданию термоядерного реактора. Они доказали, что такая «топка» возможна, хотя в природе нет и не может быть материала, способного выдержать такую температуру. Молекулы любого вещества, атомы любого элемента при таком немыслимо чудовищном «жаре» полностью разрушаются и теряют все свои электроны. Все вещества полностью превращаются в плазму — газ, состоящий не из молекул и даже не из атомов, а из свободных атомных ядер и свободных электронов. И несмотря на эту, казалось бы, полную принципиальную невозможность решения, наши ученые нашли путь, как создать такую топку для термоядерного реактора. Они доказали, что ее стенками могут служить мощные электромагнитные поля. Неощутимые, невидимые, прозрачные, они будут непроницаемы для ядер тяжелого водорода и для любых других элементов даже при ста, а может быть, и больше миллионов Кельвинов.
На сколько времени хватит человечеству энергии, скрытой в воде! Не менее чем на миллиард лет.
2i.SU ©® 2015