Химия
Введение
Плутоний
Посмотрите на фотографию (стр. 400), она была опубликована в 1944 г. Сразу и не поймешь, что на ней изображено. Подпись стояла такая: «20 микрограммов гидроокиси плутония (увеличено в 40 раз)». Рассмотреть ничтожное количество вещества на дне тончайшего капилляра без микроскопа рказалось невозможным. Фотография эта имеет огромное историческое значение — она отражает первые шаги в изучении химии поистине уникального химического элемента.
Судите сами. В 1940 г. американские физики Г. Сиборг и А. Валь с помощью ядерных реакций синтезировали первые атомы нового элемента с порядковым № 94. Сейчас мировое производство плутония измеряется многими сотнями килограммов. И когда говорят, что плутоний принадлежит к числу наиболее изученных представителей периодической системы Менделеева, то, поверьте, в этом утверждении нет никакого преувеличения по одной простой причине: плутоний является важным топливом ядерных реакторов (см. ст. «Атомный реактор»).
Его относят к искусственно синтезированным элементам. Но в то же время плутоний оказывается элементом с наибольшим порядковым номером из всех обнаруженных в природе, так сказать, своеобразной естественной верхней границей периодической системы. Он постоянно образуется в природе, хотя и в очень малых количествах.
Как это происходит? Благодаря различным природным ядерным реакциям (например, спонтанному делению урана) возникают свободные нейтроны. Они захватываются ядрами урана-238:
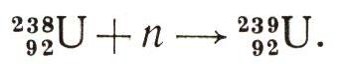
А далее следует такая цепочка радиоактивных превращений:
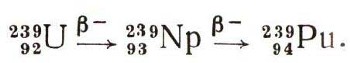
Ученые подсчитали, что на 1 г урана в урановых минералах приходится 10-12 г плутония. Общие же «ресурсы» природного плутония превышают 2500 т. Это обстоятельство весьма интересно: ведь если бы плутоний не был получен искусственно, его рано или поздно удалось бы обнаружить в природе.
Всего теперь известно 15 изотопов плутония. Знакомый уже нам 239Pu имеет период полураспада 24 360 лет, но в плеяде плутониевых изотопов он не самый долгоживущий. Куда большей продолжительностью жизни обладают 242Рu (3,8*105 лет) и 244Pu (7,6*107 лет), но в природе они не образуются. Недавно в природе был обнаружен первичный плу-тоний-244. Зато с практической точки зрения плу-тоний-239 самый важный. Он легче других делится под действием медленных нейтронов, при этом выделяется огромная энергия.
На этом изотопе плутония были изучены свойства нового элемента. Изучение требовало огромных предосторожностей. Радиоактивность плутония настолько высока, что в обычной химической лаборатории с ним работать нельзя. Исследования ведут в специальных помещениях — так называемых горячих камерах. Все операции производятся с помощью дистанционного управления. Сам ученый не дотрагивается до колб и пробирок. Руки химика в «горячих лабораториях» заменены хитроумными рычагами и захватами. Иначе нельзя: радиоактивное излучение плутония опасно для жизни.
У плутония большое преимущество перед другими трансурановыми элементами. Его можно накапливать во внушительных количествах (благодаря образованию в урановых реакторах). Однако это вовсе не значит, что можно хранить слитки металлического плутония любых разумных размеров. Как и у урана, у плутония существует критическая масса. Плутониевый шар массой около 2,5 кг претерпел бы мгновенный ядерный взрыв. Однако плутоний не относится к тем материалам, которые залеживаются на складах...
Как химический элемент плутоний во многом необычен. Нет единого мнения относительно его места в менделеевской таблице. Одни ученые причисляют его к семейству актиноидов, другие относят к более малочисленной группе уранидов, третьи считают, что плутонию нужно предоставить самостоятельное место в восьмой группе периодической системы (см. ст. «Великий закон»). Химия плутония очень богата, поскольку он может выступать в различных валентных состояниях — от трехвалентного до шестивалентного. Плутоний-VI похож на уран, а плуто-ний-III имеет много общего с лантаноидами. Словом, плутоний заключает в себе обширную гамму свойств.
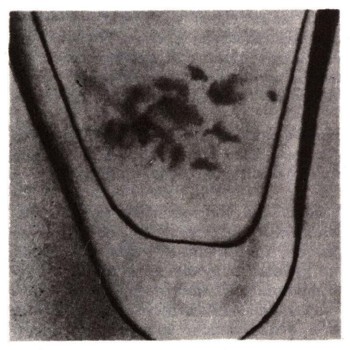
Чистая гидроокись плутония (20 мкг) на дне капиллярной трубки. Увеличено в 40 раз.
В 1967 г. советские ученые А. Д. Гельман, Н. Н. Крот и М. П. Мефодьева получили семивалентные соединения элемента. В химии трансурановых элементов этот результат рассматривается как открытие первостепенной важности. Он заставляет пересмотреть многие сложившиеся представления о закономерностях изменения свойств элементов в конце периодической системы. Химики приготовили и изучили не менее 100 самых разнообразных соединений плутония, больше, чем для всех других трансуранов, вместе взятых.
По внешнему виду плутоний при комнатной температуре — белый блестящий металл. Если его нагревать до плавления, то с ним происходят удивительные превращения. Прежде чем металл станет жидкостью, он несколько раз изменит свою кристаллическую структуру. Такое явление, когда один и тот же элемент известен в разных кристаллических состояниях, называют аллотропией. У плутония шесть аллотропических модификаций (разновидностей). Подобного изобилия нет ни у одного из известных металлов.
При а-распаде плутония выделяется очень много тепла. Это тепло с помощью специальных преобразователей можно превратить в электрическую энергию. Особенно ценен в этом отношении короткоживущий изотоп плутония-238 (период полураспада 86,4 года). Он уже используется в изотопных источниках тока и для питания оборудования космических аппаратов.
2i.SU ©® 2015