Химия
Введение
Фтор
В правом верхнем углу периодической системы Менделеева под номером 9 стоит элемент фтор — первый представитель группы галогенов. Этот элемент следовало бы выделить среди других особым цветом или яркой рамкой, потому что свойства его удивительны и не всегда понятны, химическое поведение своеобразно: он ни на что не похож, строптив, обладает необычайной реакционной способностью. Это самый активный элемент-неметалл из существующих в природе.
История фтора уходит в далекое прошлое и связана с драматическими ситуациями, сюрпризами и удивительными находками. Первое известное соединение фтора, о котором в XV в. упоминает Базилиус Валентинус, — фторид кальция, или плавиковый шпат. Ученый обнаружил способность минерала снижать температуру плавления руды и образовывать жидкие шлаки. Этот минерал назвали флюоритом и стали применять в металлургии как флюс.

Лаки, краски, ядохимикаты, лекарства и многое другое в виде растворов во фреоне упаковываются в аэрозольные контейнеры. При необходимости они извлекаются под собственным давлением в распыленном или пенообразном состоянии.
В XVIII в. шведский химик К. Шееле установил, что серная и другие кислоты освобождают из плавикового шпата какую-то особую кислоту; в шпате она соединена с известью. Шееле назвал эту кислоту плавиковой, или кислотой флуория. Ученый не смог определить точно состав плавиковой кислоты, но доказал, что в ней содержится новый, очень активный элемент. Таким образом, честь открытия фтора принадлежит Шееле. Однако потребовалось еще около ста лет, чтобы получить фтор в свободном состоянии.
Ученые были убеждены в существовании фтора. В основе этих убеждений лежали аналоги соединений фтора с соединениями других галогенов: хлора, брома и иода. Но быть убежденным в существовании элемента и действительно выделить его в свободном состоянии — не одно и то же. Фтор как бы не хотел расставаться с металлами, связанными с ним в солях, и сопротивлялся любой попытке перевести его из мира загадок в мир известного.

С помощью аэрозолей можно смывать грязь и масло с двигателей, красить машины, мебель.
Фтор не только хранил свою тайну, но и жестоко мстил тем, кто хотел в нее проникнуть. Первыми жертвами фтора были ирландские ученые братья Георг и Томас Нокс. Томас отравился фтористым водородом и умер, а Георгу пришлось долго лечиться. Бельгийский профессор П. Луйэ, самоотверженно продолжавший опыты братьев Нокс, вскоре тоже поплатился жизнью. Такая же участь постигла французского химика Д. Никле, изучавшего способы получения фтора.
Однако ничто не могло остановить любопытство человека. Много времени и сил отдали химии фтора всемирно известные ученые А. Ампер, М. Фарадей, Э. Фреми, Ж. Гей-Люссак, Г. Дэви. И хотя их работы так и не привели к получению свободного элемента, о фторе и его соединениях становилось известно все больше и больше.
В 1863 г. получением фтора занялся известный французский химик Анри Муассан. Он воспользовался результатами своих предшественников, и особенно наблюдениями своего учителя Э. Фреми. В 1886 г. Муассану удалось получить свободный фтор электролизом фтористого водорода, т. е. способом, который безуспешно применяли его предшественники. Но чтобы еще раз проверить чистоту исходных продуктов, ученый подверг фтористый водород вторичной перегонке. Это стало причиной неудачи повторных опытов — чистая кислота не проводила электрический ток. Пузырьки газообразного фтора не появлялись. Лишь в последующих работах Муассану удалось показать, что только при добавлении нескольких кристалликов фторида калия фтористый водород становился проводником тока. Успех первых опытов и объяснялся присутствием примеси соли.
Теперь мы знаем: чтобы получить свободный фтор, необходимо отнять от иона фтора электрон, очень прочно связанный с атомом элемента. Характеризуя эту особенность, химики говорят, что фтор отличается исключительно высоким сродством к электрону. Поэтому задача освобождения фтора могла быть разрешена только при помощи электрического тока — универсального окислительно-восстановительного агента, которому можно придать любой "окислительный потенциал», изменяя электрическое напряжение.
Длительная и волнующая история поисков свободного фтора, полная неудач и трагических происшествий, закончилась победой химиков. Таинственны фтор, светло-желтый газ с резким раздражающим запахом, был получен. По запаху можно обнаружить в воздухе присутствие одной миллионной грамма фтора. При температуре минус 188° С он превращается в жидкость канареечно-желтого цвета. Только недавно ученые установили, что при температуре кипения плотность жидкого фтора более 1500 кг/м3. Это оказалось очень важно для ракетной техники.
Когда фтор выделили из соединений с другими элементами, была обнаружена его поразительная реакционная способность. Оказалось, что этот газ реагирует почти со всеми известными элементами и соединениями: при комнатной температуре воспламеняет бумагу, древесину, уголь и асбест. Он поджигает даже воду и без особых усилий может воспламенять многие металлы, разрушает стекло, фарфор и большинство минералов.
Фтор — сильнейший окислитель, более сильный, чем кислород, поэтому он реагирует с большинством окислов, вытесняя из них кислород. В частности, это происходит и с водой. Реакция идет так энергично, что вода буквально горит:
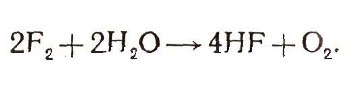
Нагретая вода горит в струе фтора бледно-фиолетовым пламенем. При этом образуется фтористый водород. В этой реакции в отличие от других реакций горения кислород является не причиной, а продуктом горения.
После первых успешных опытов по выделению фтора начались попытки укрощения и использования его необычайных свойств. Эта работа, полная интересных и значительных открытий, позволила ученым-химикам получить новые вещества с удивительными свойствами, которых не существовало в природе.
Оригинальность химического поведения фтора и удивительные результаты его взаимодействия с другими элементами и их соединениями вызваны рядом причин, в частности его высокой электроотрицательностью и очень большим потенциалом ионизации. Электроотрицательность фтора (в условных единицах) составляет 4; кислорода — 3,5; азота и хлора — 3; углерода — 2,5; лития — 1. Это значит, что атом фтора сильнее атомов всех других элементов притягивает электроны и труднее всего их отдает. Атомы фтора очень малы по размерам, поэтому они плотно располагаются вокруг атомов других элементов. В результате образуются соединения, богатые фтором. Исследование соединений фтора до начала XX в. охватывало преимущественно область неорганических фторидов.
Первое фторорганическое соединение было синтезировано более ста лет назад выдающимся ученым-химиком и великим русским композитором А. П. Бородиным. Однако химия этих веществ начала развиваться только последние 30—40 лет. Особенно важны работы бельгийского химика Ф. Свартса, который всю свою жизнь посвятил исследованиям фтора. Сначала он разработал способы получения сравнительно простых органических соединений, в которых водород был частично заменен фтором. Известно, что галогенопроизводные получаются прямым воздействием на углеводороды хлора, брома и иода. Для фтора этот способ непригоден: он обладает настолько высокой реакционной способностью, что при фторировании возникают быстрые цепные экзотермические реакции, в ходе которых молекулы фторируемого вещества разрушаются. Так, еще Муассан установил, что фтор реагирует с органическими соединениями и даже с углем чрезвычайно бурно. В результате реакций образуется уголь, фтористый водород и тетрафторметан (CF4). Позднее ряду ученых удалось выделить при подобных реакциях тетрафторметан и небольшое количество других, полностью фторированных углеводородов. Это были, по-видимому, первые фтор-углероды — соединения, состоящие только из фтора и углерода.
Что это такое? (Отгадку найдете на одной из страниц этого тома ДЭ, если хорошенько поищете.)
Свартс пошел иным путем. Он разработал метод косвенного фторирования, в котором использовал действие фторидов металлов, например фтористой ртути, серебра и особенно сурьмы, на другие галогенопроизводные углеводородов. При этом происходил обмен имеющегося в молекуле другого галоида на фтор. Свартсу удалось получить большое количество соединений, содержащих фтор: фторированные спирты и эфиры, трифторуксусную кислоту и некоторые фторуглероды. Эти исследования принесли Свартсу славу выдающегося химика. Но ни одно из синтезированных веществ не нашло практического применения. К ним относились как к любопытным курьезам химии, и только. Сейчас это кажется странным, но так было в действительности. Многие только догадывались об их своеобразных свойствах и не могли наметить пути их использования.
Постепенно, шаг за шагом, познавалась химическая сущность новых веществ: у некоторых фтор-и фторхлорэтанов были обнаружены интересные термодинамические свойства. Еще до второй мировой войны их пытались применить в холодильной технике в качестве хладоагентов.
В ходе второй мировой войны началась гонка за овладение новым, в том числе атомным, оружием. Вероятно, Свартс, который умер в Бельгии во время немецкой оккупации, не представлял себе, что фторуглероды вызовут огромный интерес у химиков, занятых в «Манхэттенском проекте» (кодовое название работ по созданию атомной бомбы в США). На крошечных образцах, хранившихся в Пенсильванском университете, удалось обнаружить стойкость фторуглеродов к очень агрессивному веществу — гексафториду урана. Как оказалось, этот фтор-углерод (перфторгептан) смешивался с гексафторидом урана, но не вступал с ним во взаимодействие. Препарат прошел испытания и был немедленно засекречен. Он получил условное название «Вещество ДЖО» по имени химика Джорджа Саймонса.

На основе фторопласта-4 можно изготовить лыжную мазь или специальное покрытие для лыж, которое пригодно для любой температуры. Дело в том, что коэффициент трения фторопласта-4 фактически не зависит от температуры.
Так была открыта необычайная химическая стойкость новорожденных фторуглеродов, которую стали использовать в атомной промышленности. Это послужило мощным толчком для развития химии фтора в целом. Ученые старались собрать все то немногое, что было известно о химии соединений фтора, чтобы получить новые и лучшие вещества. Результаты вскоре сказались.
Началось широкое применение фторуглеродов в технике. Но сначала расскажем еще об одном их применении во время второй мировой войны. Английские и американские войска на тихоокеанском театре военных действий несли огромные потери, но не только в результате ожесточенных боев, а из-за массовых заболеваний от укусов комаров и москитов. Обычные способы борьбы с насекомыми были малоэффективны. Тогда легко кипящие фтор-и фторхлоруглероды применили как растворители для инсектицидов в аэрозольных баллонах. Таким способом удалось быстро и экономично распылять инсектициды и уничтожать носителей инфекций.
После этого открытия начала развиваться и промышленность аэрозолей. Лаки, краски, ядохимикаты, лекарства и многое другое упаковываются в аэрозольные контейнеры в виде раствора во фре-оне (фторхлоруглероде). Оттуда при необходимости они под собственным давлением выходят в распыленном или пенообразном состоянии. С помощью упаковок под давлением можно смывать грязь и масло с двигателей, красить стены и мебель, наносить защитные слои на картины и чертежи и т. д.

С помощью аэрозольных баллонов можно быстро и экономично распылять инсектициды для защиты растений от вредителей.
Слово «фторуглероды» начало входить в химический лексикон примерно в 40-е годы XX в. Теперь его знают уже не только химики. Это слово относится к современной новой области химии и объединяет сотни тысяч новых веществ. За очень редким исключением, этих веществ нет в природе. Они созданы человеком.
Фторуглероды являются химическими братьями углеводородов. Строение фторуглеродов и углеводородов, в сущности, одно и то же. Единственная разница состоит в том, что в молекуле фторуглеродов все атомы водорода заменены на атомы фтора. На этом их сходство заканчивается. По реакционной способности, по отношению к температуре, по своей устойчивости и многим другим химическим и физическим свойствам оба ряда веществ ведут себя совершенно различно. Нам уже известно, что фтор чрезвычайно активно взаимодействует с другими элементами и веществами. При реакциях фторирования выделяется огромное количество тепла. Вступая в химическое взаимодействие, фтор растрачивает свою могучую энергию и образует очень стойкие соединения, характеризующиеся высокими значениями энергии связи фтора с углеродом. Чтобы разрушить такое соединение, надо затратить не меньшую энергию, чем та, которая выделилась при его образовании.
Это один из «секретов» фтора как источника энергии и одна из причин необыкновенной стойкости фторуглеродов. Другая причина их устойчивости в том, что атомы фтора, окружающие углеродный скелет, фактически теряют способность реагировать с кислородом или окислительными агентами. Атомы же углерода, соединившись с фтором, находятся в предельно окисленном, пассивном состоянии. Панцирь из атомов фтора не только защищает углеродный скелет, но и делает молекулы фторуглеродов практически не способными к взаимодействию с другими молекулами того же типа. Этим объясняется низкая температура кипения фторуглеродов при их высокой молекулярной массе, низкое поверхностное натяжение и слабая адгезия, т. е. слабая способность к прилипанию.
Фторуглероды оказались превосходными изоляторами. Выдерживая высокое электрическое напряжение, они не подвергаются разложению и предотвращают диэлектрические потери. Наряду с термической и химической стабильностью они обладают еще отличными термодинамическими свойствами. Сочетание стольких качеств в веществах, которые к тому же безвредны, быстро определило их использование в современной технике.
С каждым годом у них открываются все новые и новые «профессии». Без фторуглеродов уже немыслимы современные холодильники и кондиционеры воздуха. Их используют, например, в качестве веществ, снимающих тепло, при создании миниатюрных аппаратов большой мощности, что особенно важно в электронной и авиационной технике. С помощью фторуглеродных жидкостей охлаждают трансформаторы, радарные лампы высокой мощности и другие электронные устройства.
Современные самолеты, автомобили, ракеты и самые разнообразные механизмы нуждаются в смазочных материалах, гидравлических жидкостях. Если эти материалы делать из нефтепродуктов, то они легко воспламеняются и разрушаются при высокой температуре. У высококипящих фторуглеродов подобных недостатков нет. В различных конструкциях они служат как смазки и гидравлические жидкости настолько долго, что их называют вечными маслами. Благодаря высокому содержанию фтора эти масла стойки ко всем видам окисления, будь то горение на воздухе или химическое воздействие окислителей. С помощью фторуглеродных масел можно будет создать двигатели нового типа, работающие при более высоких температурах и в более жестких условиях.
Исследуя фторированные олефины (аналоги и гомологи этилена), ученые получили фторированные полимеры, каучукоподобные и многие другие вещества — спирты, кислоты, сульфиды, амиды. Первые полимеры были получены из тетрафторэтилена и трифторхлорэтилена. Не обошлось здесь и без сюрпризов. Полимер тетрафторэтилена был открыт случайно. Химик Планкет исследовал реакции фторолефинов. Из баллона прекратилась подача тетрафторэтилена, хотя в баллоне должно было быть еще много газа. Когда баллон вскрыли, обнаружилось, что он заполнен белым порошком, напоминающим асбест. Это и был первый полимер тетрафторэтилена, который позднее назвали органическим благородным металлом. Случайные обстоятельства оказались ключом к большому открытию. Теперь политетрафторэтилен, или фторопласт-4, — важнейший из фторполимеров и пластиков вообще. Он отличается удивительной химической инертностью — не изменяется в горячих крепких кислотах и щелочах и даже в «царской водке», растворяющей золото. Фторопласты по стойкости к агрессивным средам превосходят благородные металлы. Благодаря своим диэлектрическим свойствам фторопласт-4 и другие фторполимеры стали незаменимыми материалами в электротехнической и радиоэлектронной промышленности. Фторопласт-4 химически инертен, безвреден для живых организмов. Поэтому его успешно применяют в разных областях восстановительной хирургии. Из фторопласта-4 делают протезы суставов, кровеносных сосудов и даже клапанов сердца. Кроме твердых пластиков из фторуглеродов теперь получают эластичные материалы, которые обладают свойствами каучука. Эти фторкаучуки не набухают в бензине и керосине, выдерживают воздействие крепких серной и азотной кислот. Обыкновенная резина в таких условиях разрушается чрезвычайно быстро.
Свойство фторуглеродов снижать поверхностное натяжение используется для синтеза новых поверхностноактивных веществ (ФПАВ), сохраняющих свои свойства в сильных кислотах и щелочах. Обычные углеводородные поверхностноактивные вещества (ПАВ) при этом разрушаются. Бумага, текстильные ткани, кожа, обработанные ФПАВ, становятся водо- и маслоотталкивающими. Соединения фтора применяют также при синтезе прочных светоустойчивых красителей, отличающихся особой яркостью и глубиной цвета.
Физико-химические особенности фтора дают возможность создавать не только стабильные, но и очень реакционноспособные соединения с биологической активностью. Уже синтезировано большое количество лекарств, например препараты для лечения болезней щитовидной железы, заменители хинина и противовоспалительные средства (мази — сина-лар, оксикорт и др.).
В некоторых растениях были найдены ядовитые фторсодержащие вещества — фторацетаты. В Южной Африке растет ядовитое растение гифтблар. Его сок — сильнейший яд. Интересно, что растение встречается в местах с повышенным содержанием фтора в почве и воде. Это один из очень редких примеров существования природных органических соединений фтора. Вместе с бурным развитием химии фторорганиче-ских соединений в 60-е годы начала вновь развиваться неорганическая химия фтора. В 1963 г. удалось показать, что фтор способен взаимодействовать с инертными газами — ксеноном и криптоном (XeF6, KrF4); до этого инертные газы называли химической пустыней, так как они не вступали в какие-либо реакции.
В поисках новых источников энергии для движения ракет еще К. Э. Циолковский обратил внимание на фтор. Современные исследования подтвердили, что фтор как окислитель ракетного топлива эффективнее кислорода. Вместе с высокой реакционной способностью в этом случае важна высокая плотность жидкого фтора. Применение фтора в ракетной технике весьма перспективно.
Химия фтора является поставщиком уникальных химических и термически стойких материалов, пластиков, эластомеров, фреонов, вечных масел, без которых немыслимо решать важнейшие вопросы авиационной, космической, электронной и даже медицинской техники.
В то же время химия фтора богата чрезвычайно активными и энергоемкими соединениями, к числу которых относятся фториды галогенов, кислорода, азота и сам фтор. Многие из них также могут служить источником энергии в ракетной технике. Соединения фтора, обладающие физиологической активностью, обещают привести к интересным результатам, особенно в создании новых лекарственных веществ. Новые проблемы, выдвигаемые современной наукой и техникой, могут успешнее разрешаться, если заниматься тщательным исследованием малоизученных элементов и создавать на их основе новые структуры. Открытие новых соединений фтора — крупнейшее достижение современной химии
2i.SU ©® 2015