Химия
Введение
Заглянем в будущее
Пустых мест в менделеевской таблице больше нет. Все они уже заполнены. Все элементы открыты. Уже создано немало новых, каких никогда на Земле не бывало. Так, может быть, все уже сказано? Может быть, могучая идея Д. И. Менделеева, многие десятки лет руководившая развитием химии, завершила все, что она могла дать, и для нее остается только почетная роль повседневной помощницы химиков в их будничной работе? Может быть, принцип периодичности, на котором основана естественная система химических элементов, ограничен только электронной оболочкой атомов? Нет, это неверно. Когда великий ученый начинал свою работу над естественной системой химических элементов, из 92 известны были 63, а о существовании многих других вообще никто не подозревал. Сколько же элементов мы знаем теперь? Сколько изотопов известно для каждого элемента? Сколько различных атомных ядер существует в природе? Сколько новых создано человеком?
Мы знаем теперь 105 химических элементов. Наверное, скоро будут синтезированы 106-й и 107-й элементы. Ведутся эксперименты, которые, возможно, позволят ученым прорваться в очень далекие области периодической системы. Физики-теоретики предсказывают: элементы с порядковыми номерами 110, 114, 126 окажутся достаточно долгоживущими и поэтому их удастся не только синтезировать, но и изучить их свойства (см. ст. "Вымершие и воссозданные элементы").
Эти элементы найдут свое место в таблице Менделеева. Сто десятый элемент должен быть химическим аналогом платины, еще одним благородным металлом восьмой группы. Менделеев назвал бы его экаплатиной. Элемент № 114 был бы ближайшим родственником свинца - экасвинцом. А сто двадцать шестой... Ни один химик в мире не взя" бы на себя смелость предсказать его свойства.
Почему? Чтобы ответить на этот вопрос, обратимся к периодической системе (стр. 368). Такое изображение менделеевской таблицы ныне является самым распространенным, удобным и содержательным. Его называют короткой формой таблицы. Не правда ли, она напоминает здание, очень стройное и изящное в архитектурном отношении?
К сожалению, в этой стройности скрываются несоответствия. Видите ряд элементов, расположенный в самом низу таблицы: актиноиды. Так же как 14 лантаноидов из шестого периода все помещаются в одной-единственной клетке лантана, так и 14 актиноидов все занимают клетку актиния в седьмом периоде. По отношению к лантаноидам этот прием в общем правилен, так как 14 элементов, от церия до лютеция, очень похожи друг на друга и на лантан.
А в случае актиноидов такого химического подобия нет. В первой половине этого семейства каждый элемент имеет самостоятельное лицо. Торий непохож на актиний, уран отличается и от своего левого соседа - протактиния и от правого - нептуния. Свои отличительные особенности у плутония, америция и кюрия.
Для лантаноидов особенно характерна почти постоянная валентность, она равна 3, и только некоторые редкоземельные элементы могут быть четырехвалентными (церий, празеодим, тербий) или двухвалентными (самарий, европий, иттербий). Трехвалентное состояние самое устойчивое.
Каждый из актиноидов располагает весьма богатым арсеналом валентностей. Например, уран может иметь валентности, равные 2, 3, 4, 5 и 6. Нептуний и плутоний идут еще дальше. В 1967 г. советские ученые Н. Н. Крот, А. Д. Гельман и М. П. Ме-фодьева обнаружили, что эти элементы могут быть семивалентными. Лишь после кюрия актиноиды, образно говоря, становятся ровнее в своем химическом поведении, трехвалентное состояние оказывается преобладающим. Но и здесь свои сюрпризы.
Наш рассказ преследовал одну цель: убедить вас, что считать актиноиды семейством химических элементов, подобным лантаноидам, ни в коем случае нельзя. И само название "актиноиды" не является строгим: ведь оно означает "подобные актинию". А разве торий, или уран, или нептуний похожи на актиний, который иначе как в трехвалентном состоянии не встречается? Название "актиноиды" предложил в 1945 г. американский ученый Г. Сиборг, но в те времена трансурановых элементов было еще очень мало, а свойства их только начинали изучать.
А в итоге получается: в седьмом периоде системы элементов существует большая их совокупность, которая не может быть размещена в таблице так, чтобы химик с этим размещением согласился.
Теперь посмотрите: в 104-й и 105-й клетках таблицы мы поместили два недавно синтезированных химических элемента. Курчатовий, как показала оценка его химической природы, похож на гафний, а 105-й - на тантал. Но ведь многие десятилетия аналогами гафния и тантала рассматривались соответственно торий и протактиний. И ниже вольфрама стоял уран. Никто такого расположения не оспаривал вплоть до.появления идеи о семействе актиноидов.
Какой же элемент ставить под гафнием: торий или курчатовий? Какой из двух элементов: протактиний или 105-й считать непосредственным аналогом тантала? Стройность планировки здания периодической системы в его нижнем этаже - седьмом периоде -заметно нарушается. Природа-архитектор эту планировку весьма усложнила. Рамки менделеевской таблицы оказываются слишком жесткими, чтобы безупречно разместить элементы с порядковыми но-мерами от 90 до 105 и далее.
Наконец, можно обратиться к 126-му элементу. Он будет принадлежать к восьмому периоду, который начнется 119-м элементом - экафранцием. Интересная особенность восьмого периода состоит в том, что он должен содержать 18 элементов, в атомах которых будет впервые заполняться 5g-подобо-лочка (значение орбитального квантового числа l = 4).
Элемент 126, по-видимому, должен быть членом удивительного семейства 5g-элементов. Поскольку в их атомах заполняется четвертая снаружи электронная оболочка, то их свойства могли бы оказаться сходными еще в большей степени, чем это мы видели на примере лантаноидов. Это была бы беспримерная химическая близость.
Некоторые ученые считают: так именно дело обстояло бы в действительности, если бы эти элементы существовали (или если бы их удалось синтезировать). Тогда и с элементом 126-м все было бы ясно, и его свойства легко было бы предсказать.
Быстродействующие электронно-вычислительные машины помогают физикам рассчитывать электронные конфигурации атомов неизвестных элементов седьмого и восьмого периодов. Если мы знаем, как устроен атом, то можем судить о свойствах соответствующих элементов. По расположению электронов в атомах 110-го и 114-го элементов можно рассматривать их родственниками платины и свинца.
Для восьмого периода машины дают совершенно неожиданные ответы. Порядок заполнения электронных подоболочек оказывается чрезвычайно сложным. Деталей мы не знаем и не узнаем до тех пор, пока не будут синтезированы какие-либо из "сверхэлементов". Но одно кажется довольно ясным: едва ли 5g-элементы образуют в таблице новую семью химических близнецов. Их химия не будет такой же однообразной, как у лантаноидов. Она будет очень богатой и интересной, полной сюрпризов.
Загадки периодической системы сейчас скрываются в ее седьмом и восьмом периодах. Химик Может пытаться их решать пока что на бумаге. Ядерная физика должна найти и осуществить на практике способы синтеза элементов, расположенных на краю таблицы Менделеева.
Нет ни одного элемента, у которого был бы только один изотоп. Одни элементы состоят из доброго десятка различных видов атомов, у других вообще нет устойчивых изотопов, но нет ни одного элемента, у которого не было бы радиоактивных изотопов.
Всего теперь (1973) уже известно более 1800 различных атомных ядер для 105 элементов. Сколько же из них создала природа и сколько создано человеком? Такое сопоставление приводит к неожиданному и удивительному результату. В природе найдено для 89 элементов только около 325 различных изотопов. Совсем еще недавно считалось, что в природе очень мало неустойчивых радиоактивных изотопов.
Было установлено, что 17 радиоактивных изотопов принадлежат ряду урана, в ряде распада тория их 11, в цепочке распада урана-235 найдено 14 изотопов. Кроме них в природе были обнаружены радиоактивные "одиночки": калий-40, рубидий-87 и несколько других.
Было установлено также, что в природе, на границе с космосом, образуются непрерывно и непрерывно исчезают углерод-14 и изотоп водорода -тритий. Остальные природные изотопы - более 275 - считались устойчивыми. Но за последние годы развитие измерительной техники привело к неожиданным результатам. Многие из тех изотопов, которые безусловно считались стабильными, вечными, оказались в действительности тоже неустойчивыми, радиоактивными. Таких уже найдено свыше 50.
Среди них есть и поистине удивительные: например, висмут-209 с измеренным периодом полураспада более 2*1018 лет (!), или кальций-48, живущий свыше 1*1018 лет, или изотоп свинца-204, распадающийся наполовину за 1,4*1018 лет. По сравнению с такими "Мафусаилами", продолжительность жизни которых во много раз превышает возраст самого земного шара, такие изотопы, как железо-58, цинк-64, платина-192 (живут "всего лишь" около 1015 лет), можно, пожалуй, назвать "короткоживущими" (!).
С точки зрения науки наших дней трудно уже разграничивать стабильные и нестабильные виды атомных ядер. Несомненно, по мере роста точности и чувствительности измерений будут обнаруживаться все новые и новые, еще более долгоживущие, но, бесспорно, неустойчивые радиоактивные изотопы. И становится оправданным предположение, что, может быть, вообще не могут существовать абсолютно устойчивые, вечные атомные ядра. Всякое вещество всегда изменчиво.
Итак, в природе немногим более 300 различных ядер. Но только за время, истекшее с той поры, как были найдены пути к созданию новых радиоактивных элементов, человек уже сумел получить свыше 1800 новых радиоактивных ядер для всех без исключения элементов.
Будут ли установлены когда-нибудь какие-либо общие закономерности в тех свойствах вещества, которые, зависят только от атомного ядра? Это очень большой и принципиально важный вопрос. От ответа на него зависит в будущем и познание природы человеком. Ответ на него - это путь к познанию строения атомного ядра, сегодня во многом еще недоступного. Но мы уже можем сказать, что это будет сделано. И начало будущего ответа на этот важнейший вопрос, который решит наука будущего, намечается в периодической таблице атомных ядер. Посмотрите внимательно на начальную часть таблицы (стр. 369), которую можно назвать прообразом периодической таблицы атомных ядер. Это по существу та же периодическая таблица Менделеева, но в каждой клетке ее приведены все атомные ядра, известные для того или иного элемента. В нее включены все изотопы всех известных в наши дни элементов - как природные, так и искусственные. Целиком напечатать ее здесь нельзя: она слишком громоздка. Здесь изображено только ее начало - от водорода до скандия.
Обратите внимание на проходящую посередине таблицы толстую черную линию. Зубчатой чертой она соединяет устойчивые изотопы смежных элементов. Присмотритесь: все ядра, расположенные под этой чертой, помечены красным, а над ней они обозначены синим цветом. Эта черта разделяет по-зитронную и электронную бета--неустойчивости атомных ядер.
Очень много замечательно интересных данных содержит таблица атомных ядер, но еще больше она таит в себе. Даже представить себе трудно, сколько тайн будет открыто и какими необъятными возможностями эта таблица поможет овладеть науке!
В таблице атомных ядер четко выражена одна замечательная закономерность, сразу бросающаяся в глаза. Присмотритесь к таблице внимательно, и вы сами заметите различие между четными и нечетными элементами. У каждого нечетного элемента начиная с фтора только один (иногда два) устойчивый изотоп, а у всех четных - по нескольку устойчивых изотопов. Например, у фтора - девятого элемента - один нерадиоактивный изотоп, но зато у его соседей с обеих сторон (у восьмого - кислорода и десятого - неона) их по три. Эта загадочная закономерность может быть прослежена по всей таблице для всех элементов.
В качестве примера можно выбрать уже знакомую нам триаду: железо - кобальт - никель. Для четного железа известны четыре устойчивых изотопа, для четного никеля - пять, а для нечетного кобальта - только один. Очевидно, что с закономерностью чередования устойчивости четных и нечетных ядер связана и замечательная закономерность распространения четных и нечетных элементов в земной коре и во всем мироздании.
Но не надо думать, что этим и ограничиваете" периодическая закономерность, проявляющаяся в таблице атомных ядер. Систематическое изучение свойств огромного числа стабильных и радиоактивных ядер всех природных и искусственных изотопов приводит к очень важному выводу, что в атомном ядре существуют энергетические уровни, подобно тому как существуют энергетические уровни во внешних электронных оболочках атомов.
Сопоставление самых разнообразных свойств изотопов, зависящих от атомного ядра, с числом нейтронов или протонов, входящих в его состав, приводит к выводу, что в ядрах существуют нейтронные и протонные оболочки, что в строении атомных ядер существуют периоды так же, как существуют периоды в строении атомных оболочек. И если электронные оболочки становятся особенно устойчивыми, когда они содержат 2 (гелий), 10 (неон), 18 (аргон), 36 (криптон), 54 (ксенон) и 86 (радон) электронов, то внутриядерные нейтронные и протонные оболочки становятся наиболее устойчивыми, когда в атомных ядрах содержится 2, 8, 20, 50, 82 и 126 нуклонов (протонов или нейтронов). Эти удивительные числа - они недаром получили название магических чисел - определяют устойчивость атомных ядер и особую периодичность в изменении их физических свойств.
Изотопы с магическими числами протонов или нейтронов обладают особенно высокой распространенностью в природе, элементы с магическим числом протонов обладают особенно большим числом стабильных изотопов. Магические ядра наиболее устойчивы по отношению к захвату нейтронов при ядерных реакциях, они наиболее прочны, подобно • тому как наиболее прочны атомы благородных газов.
Все четыре цепочки радиоактивного распада урана, актиния, тория и нептуния заканчиваются на магических ядрах :
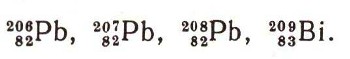
С первого взгляда может показаться, что закономерность чередования четных и нечетных элементов нарушена у хлора (17), аргона (18) и калия (19). Но это результат проявления "магических" свойств числа 20. Все ядра с 20 нейтронами устойчивы; 20 протонов в ядре С а обеспечивают устойчивость 6 изотопам.
Изучение таких свойств у атомных ядер, как магнитные свойства, абсолютная распространенность, дефект массы ядра, энергия связи, радиоактивность, показывает, что в них наблюдаются периодические изменения, периоды которых обусловлены наличием в некоторых ядрах магического числа протонов или нейтронов. На этих устойчивых ядрах заканчиваются периоды в таблице атомных ядер, аналогично тому как в таблице химических элементов периоды заканчиваются на устойчивых атомах благородных газов. На начальном участке таблицы атомных ядер намечены три первых магических числа: 2, 8 и 20.
Рано еще говорить, что уже существует периодическая система атомных ядер, но Великий закон Менделеева о периодической закономерности в свойствах химических элементов явно оказывается справедливым не только для внешней электронной оболочки атома, но и для атомного ядра, так недавно еще недоступного исследователю. Это указывает на то, что возможности, заключенные в периодическом законе, неисчерпаемы.
Можно быть уверенным, что в ближайшие годы будет создана периодическая система атомных ядер, будут вскрыты глубокие закономерности, связывающие свойства ядра с его количественными характеристиками и с его строением.
Сегодня периодическая таблица элементов служит химикам могучим оружием в борьбе за создание новых химических веществ с заранее заданными свойствами, нужными человеку. Подобно этому периодическая система атомных ядер для химика будущего станет первой ступенью на пути к осуществлению направленного синтеза новых элементов с невиданными свойствами - тех, которые будут необходимы человеку будущего.
Глубоко проникла наука в тайны строения вещества. Человек знает, как построен атом и что происходит в звездах. Одним из наиболее общих законов познанного стал периодический закон химических элементов. Но мир неисчерпаем. И снова наука стоит у порога неведомого. Перед человеком открывается новая беспредельность неизвестного. Новые великие законы должны быть и будут познаны.
Творческий, тяжелый и благодарный труд исследователя, горечь ошибок, радость открытия и неисчерпаемые возможности овладеть новыми, неведомыми, могучими силами природы достаются на вашу долю, читатели Детской энциклопедии. Будьте к этому готовы.
2i.SU ©® 2015