Химия
Введение
Причина периодичности в свойствах химических элементов
Наверное, у многих читателей этой статьи уже возникло совершенно законное недоумение. Ведь все, что было рассказано о законах квантовых чисел, управляющих постройкой атомов, - это результат приложения квантовой механики к изучению спектров различных элементов. В этом разделе не говорилось ни о химических свойствах, ни о законе периодичности. Так какое же отношение имеют эти удивительные сочетания простых чисел, объяснившие сложность и запутанность спектральных линий, к химии, к великому периодическому закону?
В природе существует глубокая внутренняя связь даже между самыми несходными и далекими явлениями и процессами. Свет и химия не лежат в ней на разных полках. Оба эти глубоко различные начала тесно связаны. Исследования спектров помогли выяснить строение атома, а знание структуры электронной внешней оболочки помогло понять причину периодичности в изменении свойств химических элементов. Эта причина заложена в периодичности строения электронных оболочек атомов. От этого и зависят все химические свойства элементов.
В самом деле, к чему привели нас квантовые числа электронов, управляющие их поведением в атоме? Ведь они получены на основании теории, созданной для объяснения спектров, совершенно независимо от исследования химических свойств элементов.
1. Доказано, что электронная внешняя оболочка атомов имеет периодическое строение. По мере увеличения заряда атомных ядер электроны начинают периодически заполнять новые слои электронной оболочки - размещаются на новых энергетических уровнях.
2. Доказано, что при этом в атоме должны повторяться одинаковые по строению и по числу электронов подгруппы в каждой последующей оболочке.
3. Сходство элементов определяется одинаковым строением наружного слоя электронной оболочки в их атомах.
Литий
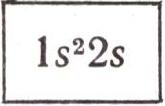
потому и стоит в одной группе менделеевской таблицы вместе с натрием
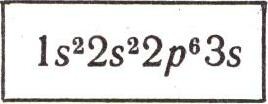
что у обоих на внешней орбите по одному s-электрону. Пожалуйста, не сочтите, что на этом теория строения атома завершена и теперь все совершенно ясно: стоит только без ошибки рассчитать по всем правилам квантовой механики и написать формулу атома — и сразу перед опытным и знающим химиком раскроются все необозримые тайны химических свойств любого элемента. Это не так. Никакая теория не может до конца охватить неисчерпаемое многообразие действительности. Как бы глубоко мы ни проникли в атомный микромир, все равно будем стоять только на пороге неведомого.
Теория строения атомных оболочек дала химии очень много. Мы теперь точно знаем, какие электроны могут быть в атоме, точно знаем, сколько их может быть в каждой из его оболочек. Но мы еще не знаем точно, в каком порядке они должны заполнять орбиты по мере роста порядкового номера элемента.
В первых трех периодах заполнение идет просто в порядке последовательности. Почему это так, мы не знаем. А чтобы определить строение атома, приходится привлекать на помощь опытные данные, полученные при изучении тонкой структуры спектральных линий и химического поведения элемента. Теоретический расчет, выраженный в несложных правилах комбинаторики простых чисел, очень многое сделал ясным в периодическом законе.
Нельзя не поражаться гению Менделеева. Он сумел уловить великое единство в необъятном хаосе, в беспорядке накопленных до него химиками разрозненных фактов и сведений. Он сумел установить естественный закон химических элементов в то время, когда еще почти ничего не было известно о строении вещества. Менделеевская таблица на долгие годы определила все развитие науки о веществе. Но и теперь, более чем через 100 лет после открытия периодического закона, пока еще даже квантовая теория не может в ней объяснить все полностью.

Нильс Хенрик Давид Бор (1885-1962)
Датский физик, член Датской академии наук и многих академий мира, в том числе иностранный член Академии наук СССР, лауреат Нобелевской премии (1922). Бор - один из создателей современной квантовой физики. В 1913 г., используя планетарную модель строения атома Резерфорда и квантовую теорию Планка, Вор дал первоначальную формулировку квантовой теории атома, которая объяснила особенности спектров атомов водорода. При этом он предложил смелую гипотезу о неприменимости законов классической электродинамики в атоме. Очень плодотворным оказался выдвинутый Бором в 1913 г. принцип соответствия между классическими и квантовыми представлениями, позволивший сделать количественные выводы о спектральных частотах и других свойствах атомов и молекул. В последующие годы Бор активно участвовал в разработке теории атомного ядра. В 1939 г. он объяснил деление ядер урана.
2i.SU ©® 2015