Химия
Введение
Как же все-таки может выглядеть атом?
Конечно, попытка "наглядно" изобразить атом на бумаге совершенно безнадежна. Всякий рисунок неподвижен, любое изображение статично. Атом - это вечный вихрь движения. Его нарисовать нельзя. Но графическая схема может все же помочь понять устройство атома, осмыслить результаты опыта и теоретического расчета.
Главные квантовые числа и электронные оболочки атома определяют энергию электронов
Атом сам на языке спектра рассказывает, что электроны, вращающиеся в нем вокруг ядра, различаются между собой. Они расположены на различных расстояниях от ядра, движутся по орбитам разной формы, у них различная скорость, а самое главное -различная энергия.
Опыт и квантовомеханический расчет показывают, что в каждом атоме может быть несколько групп электронов, различающихся между собой энергией, которые образуют вокруг атомного ядра несколько электронных оболочек.
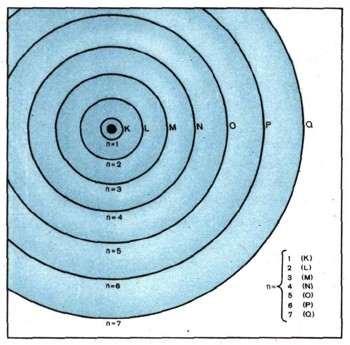
Рис. 5. Схема всех возможных электронных оболочек в атоме. Диаметры их определяются энергией электрона и пропорциональны главному квантовому числу п.
На рисунке 5 они обозначены условно окружностями. Возле каждой из оболочек указано целое число: 1, 2, 3 до 7 -это ее главное квантовое число п. Физики привыкли обозначать главные квантовые числа буквами из середины алфавита по порядку : самая близкая к атомному ядру К-оболочка, а затем идут L-, М-, N-, О-, Р- и Q-оболочки. От того, на какой, из оболочек находится электрон, и зависит его энергия. Это очень важно. На ближайшей к ядру К-оболочке он обладает наименьшей энергией. Правильнее будет представлять себе электронные оболочки в виде концентрических сфер и считать их изображением энергетических уровней электронов в аяоме.
Атом при переходе электрона с одного из внешних уровней на более глубокий излучает один фотон -квант лучистой энергии. Такие переходы электронов в атомах происходят всегда. Поэтому наши глаза и могут видеть.
Побочные квантовые числа определяют тип орбиты
К сожалению, эта простая картина атома не соответствует действительности. Выяснилось, что электроны, принадлежащие к одной и той же оболочке, могут двигаться по орбитам разного типа. Недавно еще считали, что их можно представить себе эллиптическими. Теперь думают, что такие попытки просто бесполезны и ненужны. Важно общее число различных типов электронных орбит в каждой оболочке, и очень важно, что все они разные. Физики даже говорят о существовании электронных подоболочек внутри каждой главной оболочки. Их число зависит от главного квантового числа п и равно ему. Каждый тип орбит, образующих подоболочку, характеризуется побочным квантовым числом l. Как и все квантовые числа, оно тоже целое число и может изменяться от 0 до п - 1.
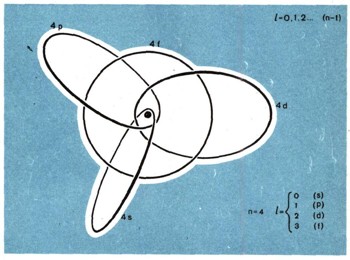
Рис. 6. Схема всех типов электронных орбит только одной N-оболочки атома. Вы сами можете легко начертить такую схему для любой другой оболочки. Только нужно иметь в виду, что отношение l полуосей в эллипсах должно быть равно l+1/n.
На рисунке 6 вы видите попытку изобразить в качестве примера типовые орбиты всех подоболочек только одной N-оболочки любого атома. Физики любят традиции и предпочитают сохранять старые буквенные обозначения для электронных подоболочек: буквы s, p, d и l. Это начальные буквы названий серий спектральных линий: резкая, главная, диффузная и фундаментальная. Они соответствуют побочным квантовым числам: О, 1. 2, 3. Однако и этого мало. Схема атома значительно сложнее. Каждая из электронных подоболочек состоит из одинаковых орбит, но число этих орбит в них различно.
Число орбит определяется значением магнитного квантового числа
Из того, как располагаются спектральные линии при излучении атомов в магнитных полях, было установлено, что в любой из главных электронных оболочек принадлежит к каждому типу строго определенное число электронных орбит. Оно зависит только от второго, побочного квантового числа и определяется третьим целым числом - "магнитным" квантовым числом m, у которого может быть 2l+1 значений: от -l до +l.
Понять это не очень трудно: каждый электрон, вращаясь на орбите вокруг ядра, по существу, представляет собой один виток обмотки, по которому идет электрический ток. При этом возникает магнитное поле, поэтому каждую орбиту в атоме можно рассматривать как плоский магнитный листок. При наложении внешнего магнитного поля каждая электронная орбита будет с этим полем взаимодействовать и стремиться занять в атоме определенное положение (рис. 7). Энергия каждой из орбит изменится, и в соответствии с этим изменится и энергия фотонов. Но и это еще не все.
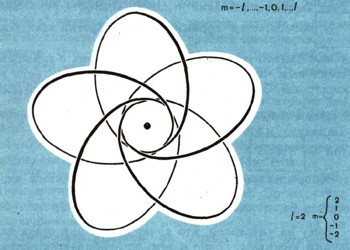
Рис. 7. Орбит только одного типа d в одной только электронной оболочке может быть пять. Сообразите, в каких оболочках возможны такие орбиты. Правильнее представлять себе, что все они различно ориентированы в пространстве.
Число электронов на орбите зависит от спинового квантового числа
Поведение атомов в сильных неоднородных магнитных полях показало, что каждый электрон в атоме ведет себя как магнитик. А это указывает на то, что электрон вращается вокруг своей собственной оси, словно планета на орбите. Это свойство электрона получило образное название спин (в переводе с английского - "вращать"),
В отличие от вращения обычных тел в нашем микромире, где возможны любые скорости вращения, вращательное движение электрона постоянно и неизменно. Это его неотъемлемое свойство. Вращение электрона совершенно необычно: ни замедлить, ни ускорить, ни остановить его нельзя. Оно одинаково для всех электронов в мире.
Но хотя спин - общее свойство всех электронов, в нем причина различия между электронами в атоме. Два электрона, вращаясь на одной и той же орбите вокруг ядра, обладают одним и тем же спином, и все же они могут различаться направлением собственного вращения. При этом изменяется знак момента количества движения и знак спина (рис. 8).
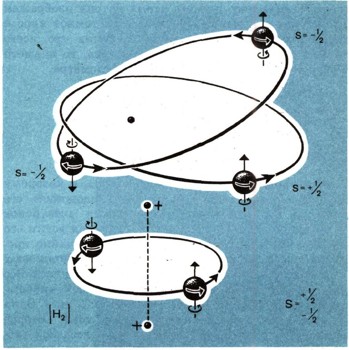
Рис. 8. На каждой отдельной орбите может быть либо только два "спаренных" электрона, либо один "неспаренный". Неспаренный электрон имеет большое значение для химической характеристики элемента. От него зависит образование молекул.
Квантовый расчет приводит к двум возможным значениям спиновых квантовых чисел, присущих электрону на орбите: s=+1/2 и s=-1/2, других значений быть не может. Поэтому в атоме на каждой орбите могут вращаться либо два, либо только один электрон. Больше быть не может.
Не смешивайте, пожалуйста, буквенное обозначение второго квантового числа l=0 с четвертым квантовым числом. И то и другое обозначают одной и той же буквой s. Наверное, просто потому, что физикам давно уже не хватает букв для их формул.
Эта теория, во многом прояснившая сложное строение атома и связавшая в единое целое его спектральные и химические свойства, основана на представлениях, впервые предложенных замечательным датским физиком Нильсом Бором.

Дмитрий Иванович Менделеев (1834-1907)
Великий русский ученый, почетный член многих иностранных академий и обществ. Величайшая заслуга Менделеева - открытие (1869) периодического закона химических элементов, являющегося естественнонаучной основой современного учения о веществе. На основе этого закона он предсказал существование и свойства нескольких химических элементов, открытых впоследствии (галлий, германий, скандий и др.). В классическом труде "Основы химии" Менделеев впервые систематически изложил всю неорганическую химию с точки зрения периодического закона. Он создал химическую, или гидратную, теорию растворов, основанную на представлении о химическом взаимодействии растворителя и растворенного вещества, открыл критическую температуру, нашел общее уравнение состояния газов. Менделеев известен важными исследованиями в самых различных областях науки и техники: метеорологии, метрологии, химической технологии, агрохимии. Менделеев -передовой общественный деятель своего времени - горячо боролся за распространение просвещения, за развитие производительных сил России.
Эта фотография Дмитрия Ивановича была сделана в то время, когда
он работал над основами периодического закона. Одно из величайших открытий
в истории мировой науки было сделано еще совсем молодым ученым. В 1869
г. Менделееву исполнилось всего тридцать пять лет.
2i.SU ©® 2015