Химия
Введение
В чем основа Великого закона
Периодический закон - великий закон природы, открытый Менделеевым, остается незыблемым. Но атомный вес, принятый им в качестве основной характеристики химического элемента, не выдержал испытания.
Именно изучение радиоактивных элементов дало возможность найти ответ на этот важный для познания окружающего нас мира вопрос. Что же заменило атомный вес? Что вместо него определяет теперь положение каждого элемента в нашей современной менделеевской таблице?
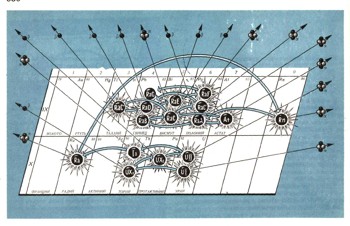
Рис. 4. Нужно очень внимательно проследить за путешествием потомков атома урана по периодической таблице. При каждом бета-распаде у них меняется заряд, а при а-распаде -и масса. Что же определяет химические свойства получающегося ядра? Теперь не пользуются устаревшими названиями U-l, U-X1 и т. п. Принято называть изотопы просто по названию элементов с добавлением массового числа. Вместо U-1 говорят U-238, вместо U-X1 - Th-234. Составьте сами таблицу изотопов, образующихся при распаде урана-238.
Проследите внимательно по периодической системе элементов за путешествием распадающегося радиоактивного ядра (рис. 4). По пути атом от урана до свинца побывает в десяти клетках двух последних рядов таблицы Менделеева. Он испытывает четырнадцать последовательных превращений, образуя по дороге восемнадцать изотопов десяти различных элементов.
Некоторые атомы на этом пути даже распадаются сразу по двум направлениям. При этом атом урана, превращаясь в конце концов в атом свинца, теряет восемь а-частиц и шесть бета--частиц. Этому соответствует потеря десяти положительных зарядов:
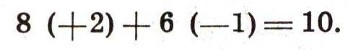
При этом с химическим элементом происходят такие глубокие изменения его химической природы, которые соответствуют его перемещению из той клетки таблицы, где находится место урана, в ту, где должен быть свинец. Десяти потерянным положительным зарядам соответствует перемещение на десять последовательных клеток в таблице Менделеева. Таким образом, химия радиоактивных элементов показала, что в основе периодического закона должен лежать другой фундамент: не атомный вес, а положительный заряд атомного ядра.
На помощь химикам пришла физика. Была предложена модель строения атома. Атом оказался сложным: вокруг положительно заряженного тяжелого ядра вращаются отрицательные электроны; их ровно столько, сколько положительных зарядов в ядре. Это и стало решающим для понимания основы периодического закона. Оказалось, что заряд атомного ядра любого элемента численно равен порядковому номеру этого элемента в таблице Менделеева. Прямое опытное доказательство этому нашел молодой талантливый английский физик Мозли, который в расцвете сил погиб во время первой мировой войны. Ему было около 24 лет, когда он сделал замечательное открытие. Изучая рентгеновские спектры элементов, Мозли нашел, что длина волны рентгеновского излучения зависит от места, которое занимает этот элемент в таблице Менделеева, от порядкового номера элемента. Измерив длину волны рентгеновского излучения элемента, можно было вычислить порядковый номер элемента, И этот номер действительно оказался равным числу положительных зарядов в ядре атома элемента.
Сложными, трудными путями развивается наука. Конечно, только знание, как -построен атом, помогло физике понять огромное значение порядкового номера элемента - основы периодического закона. Но никогда не удалось бы узнать, как построен атом, если бы у исследователей, ученых не было яркого путеводного маяка - периодического закона. Без него было бы невозможно проникнуть внутрь атома и овладеть его энергией. Без него стало бы немыслимым величайшее проявление могущества человеческого гения - создание новых искусственных элементов. Если бы Менделеев не открыл периодический закон, несомненно, этот закон все равно был бы открыт. Но кто может сказать, на сколько лет задержалось бы развитие науки! Естественная, как назвал ее Менделеев, система элементов не только требовала объяснить загадочную тайну периодичности, но она же и руководила наукой в поисках разгадки.
Запомните, что теперь 1/12 [126C]= 1
При составлении самого первого варианта периодической системы Д. И. Менделеев принимал атомную массу водорода равной единице и сравнивал с ней атомные массы всех других элементов. На Международном съезде химиков в 1860 г. было решено принять водород за основу шкалы атомных масс (в то время употребляли термин "атомный вес"). Почти полстолетия самый легкий элемент водород занимал это почетное место. Только в 1906 г. химики перешли к кислородной шкале, за основу шкалы атомных масс была принята атомная масса кислорода -ее 1/16 часть. Это, конечно, было гораздо удобнее, так как кислород образует соединения почти со всеми элементами.
Когда же было открыто, что в природе существуют три различных изотопа кислорода и что содержание их в природном кислороде непостоянно, физики установили для себя "физическую" шкалу атомных масс. Они условились принять за единицу для атомных масс 1/16 массы атома наиболее распространенного легкого изотопа кислорода и атомную массу его считать равной точно 16. Это устраняло погрешность, происходящую из-за непостоянства изотопного состава кислорода разного происхождения.
При современной высокой точности измерений такое "двоевластие" стало приводить к очень многим недоразумениям и ошибкам. Кроме того, выяснилось, что изотоп 16О не оправдывает возлагавшихся на него надежд и не может обеспечить необходимую точность. Он оказался неудобным эталоном для атомных масс. И поэтому в 1958-1961 гг. ученые еще раз пересмотрели этот исключительно важный для всего естествознания вопрос: что должно быть положено в основу современной шкалы точных атомных масс? Из всех элементов только два могли претендовать на почетную роль основной константы химии и физики - фтор и углерод.
У фтора только один изотоп, и атомная масса элемента фтора - постоянная величина. Углерод имеет два изотопа, но зато его соединения с водородом очень удобны для непосредственного сравнения масс атомов различных изотопов почти всех элементов.
Поскольку и "фторная" и "углеродная" шкалы для атомных масс обладали
каждая важными и ценными преимуществами, было решено провести всемирное
голосование (опрос) ученых - химиков и физиков: какую шкалу они предпочитают?
В этом всемирном опросе приняли участие и ученые нашей страны. Победил
углерод. Было решено за основу новой единой шкалы атомных масс принять
атом наиболее распространенного изотопа углерода 12С и считать
1/12[126С]=1.
2i.SU ©® 2015