Химия
Опыты для дома
Сера
Растворяем серу
Сера, которая, как известно, не растворяется в воде и в незначительных количествах растворяется в бензоле, спирте или эфире, прекрасно растворяется в сероуглероде CS2.
Если медленно испарять на часовом стекле раствор небольшого количества серы в сероуглероде, то получим крупные кристаллы так называемой ромбической или а-серы. Но не будем забывать об огнеопасности и ядовитости сероуглерода, поэтому потушим все горелки и поставим часовое стекло под тягу или перед окном.
Другая форма — моноклинная или b-cepa получится, если терпеливо выкристаллизовывать из толуола иглы длиной около 1 см (толуол также огнеопасен!).
Получение сероводорода и опыты с ним
Поместим в пробирку немного (с горошину) полученного сульфида железа и добавим разбавленной соляной кислоты. Вещества взаимодействуют с бурным выделением газа:
FeS + 2HCl = H2S + FeCl2
Из пробирки доносится неприятный запах тухлых яиц - это улетучивается сероводород. Если его пропустить через воду, то он частично растворится. Образуется слабая кислота, раствор которой часто называют сероводородной водой.
При работе с сероводородом надо соблюдать чрезвычайную осторожность, так как газ почти так же ядовит, как синильная кислота HCN. Он вызывает паралич дыхательных путей и смерть, если концентрация сероводорода в воздухе составляет 1,2-2,8 мг/л.
Химически сероводород обнаруживают с помощью влажной свинцовой реактивной бумаги. Чтобы получить ее, смочим фильтровальную бумагу разбавленным раствором ацетата или нитрата свинца, высушим её и разрежем на полоски шириной 1 см. Сероводород взаимодействует с ионами свинца, в результате образуется чёрный сульфид свинца. Таким способ можно обнаружить сероводород в испорченных продуктах питания (яйцах, мясе).
Мы рекомендуем получать сероводород сухим методом, так как в этом случае поток газа можно легко регулировать и перекрыть в нужное время. Для этой цели расплавим в фарфоровой чашке около 25 г парафина и смешаем с расплавом 15 г серы. Затем уберём горелку и будем перемешивать массу до застывания. Твердую массу размельчим и сохраним для дальнейших опытов.
Когда надо получить сероводород, несколько кусочков смеси парафина и серы нагреем в пробирке до температуры выше 170°С. При повышении температуры выход газа усиливается, а если убрать горелку - прекращается. В процессе реакции водород парафина взаимодействует с серой, в результате чего образуется сероводород, а в пробирке остаётся углерод, например:
C40H82 + 41S = 41H2S + 40C
Получаем сульфиды
Чтобы рассмотреть окраску выпадающих в осадок сульфидов металлов, пропустим сероводород через растворы различных солей металлов. Сульфиды марганца, цинка, кобальта, никеля и железа выпадут, еcли в растворе создать щелочную среду (например, добавив гидроксид аммония). В солянокислом растворе выпадут сульфиды свинца, меди, висмута, кадмия, сурьмы и олова.
Горение сероводорода
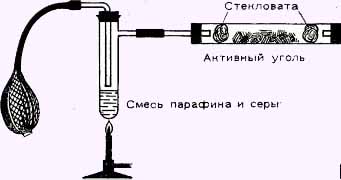
Сделав предварительно пробу на гремучий газ, подожжем сероводород, выходящий из оттянутой на конце стеклянной трубки. Сероводород горит с появлением бледного пламени с голубым ореолом:
ЗН2S + ЗО2 = 2H2O + 2SO2
В результате сгорания возникает оксид серы (IV) или серрнистый газ. Его легко определить по резкому запаху и по покраснению влажной голубой лакмусовой бумажки. При недостаточном доступе кислорода сероводород окисляется только до серы. Активный уголь каталитически ускоряет этот процесс. Этим способом часто пользуются при тонкой очистке промышленных газов, содержание серы в которых не должно превышать 25 г/м3:
2H2S + О2 = 2Н2О + 2S
Нетрудно воспроизвести этот процесс. Схема установки изображена на рисунке. Главное заключается в том, что пропустить через активный уголь воздух и сероводород в отношении 1 : 3. На угле выделится желтая сера.
Активный уголь можно очистить от серы, промыв его в сероуглероде. В технике для этой цели применяют чаще всего раствор сульфида аммония (NH4)2S.
Эксперименты с сернистой кислотой
Оксид серы (IV) — сернистый газ — чрезвычайно хорошо растворяется в воде, в результате этого образуется сернистая кислота:
H2O + SO2 = H2SO3
Она убивает микробы и обладает отбеливающим действие;. На пивоваренных и винодельческих заводах серой окуривав бочки. Сернистым газом отбеливают также корзины из ивовых прутьев, влажную шерсть, солому, хлопок и шелк. Пятна
От черники, например, выводятся, если долгое время держать увлажненное загрязненное место в “парах” горящей серы.
Проверим отбеливающее действие сернистой кислоты. Для этого цилиндр, где некоторое время горели кусочки серы, опустим различные окрашенные предметы (цветы, влажные кусочки ткани, важную лакмусовую бумагу и т. д.), хорошо закроем цилиндр стеклянной пластинкой и некоторое время подождем.
Тот, кто когда-нибудь изучал атомное строение элементов, знает, что в атоме серы на внешней орбите имеется шесть так называемых валентных электронов. Поэтому сера максимально может быть в соединениях шестивалентной. Этой степени окисления соответствует оксид серы (VI) с формулой SO3. Он является ангидридом серной кислоты:
H2O + SO3 = H2SO4
При сгорании серы в обычных условиях всегда получается оксид серы (IV). А если и образуется некоторое количество оксида серы (VI), то чаще всего он тотчас же разлагается под действием тепла на оксид серы (IV) и кислород:
2SO3 = 2SO2 + O2
При производстве серной кислоты главной проблемой является превращение SО2 в SO3. Для этой цели сейчас используются два способа: камерный (или улучшенный — башенный) и контактный. (см. опыт “Получение серной кислоты)
Получение серной кислоты
Камерный способ
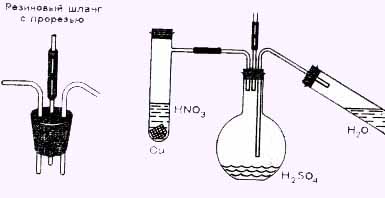
Заполним оксидом серы (IV) SO2 большой сосуд (круглодонную колбу на 500 мл), поместив в него на некоторое время горящие кусочки серы или подведя газ из аппарата, где он образуется. Оксид серы (IV) можно также относительно легко получить, капая концентрированную серную кислоту в концентрированный раствор сульфита натрия Na2SO3. При этом серная кислота, как более сильная, вытеснит слабую кислоту из ее солей.
Когда колба заполнится газом, закроем ее пробкой с тремя отверстиями. В одно, как показано на рисунке, вставим согнутую под прямым углом стеклянную трубку, соединенную с боковым отводом пробирки, в которой при взаимодействии кусочков меди и азотной кислоты образуется оксид азота (IV):
4HNO3 + Сu = Cu(NO3)2 + 2H2O + 2NO2
Концентрация кислоты должна составлять около 60% (масс.). Внимание! NO2 — сильный яд!
В другое отверстие введем соединенную с пробиркой стеклянную трубку, через которую позже пойдет водяной пар.
В третье отверстие вставим короткий кусок трубки с бунзеновским клапаном — коротким куском резинового шланга с прорезью. Сначала создадим сильный приток- в колбу окси азота. (Осторожно! Яд!) Но реакция пока не идет. В колбе находится смесь коричневого NO2 и бесцветного SO2. К только мы пропустим водяной пар, изменение окраски укажет на то, что реакция началась. Под действием водяного пара оксид азота (IV) окисляет оксид серы (IV) до оксида серы (VI), который Тотчас же, взаимодействуя с водяным паром, превращаясь в серную кислоту:
2NO2 + 2SO2 = 2NO + SO3
2NO + O2 = 2NO2
На дне колбы соберется бесцветный конденсат, а излишек газа и паров уйдет через бунзеновский клапан. Выльем бесцветную жидкость из колбы в пробирку, проверим кислую реакцию лакмусовой бумажкой и обнаружим сульфат-ион SO42- полученной серной кислоты, добавив раствор хлорид бария. Толстый белый осадок сульфата бария укажет нам успешное проведение опыта.
По этому принципу, но в гораздо большем масштабе, получают серную кислоту в технике. Раньше реакционные камер были футерованы свинцом, так как он устойчив при воздействии паров серной кислоты. В современных башенных установках применяют реакторы на керамической основе. Но большее количество серной кислоты производят сейчас по контактному способу.
Контактный способ
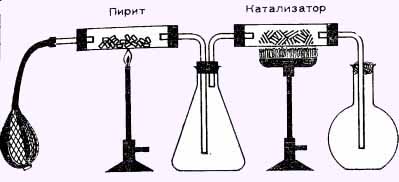
При производстве серной кислоты применяют различное сыры Чистая сера стала применяться в только в 60-х годах. В большинстве случаев на предприятиях получают оксид серы (IV) обжигом сульфидных руд. Во вращающейся трубчатой печи или в многоярусной печи пирит взаимодействует с кислородом воздуха по следующему уравнению:
4FeS2 + 11О2 = ЗFe2O3 + 8SO2
Образующийся оксид железа (III) удаляется из печи в виде окалины и перерабатывается далее на предприятиях по получению чугуна. Растолчем в ступке несколько кусочков пирита и поместим их в трубку из тугоплавкого стекла, которую закроем пробкой с отверстием. Затем горелкой сильно нагреем трубку, одновременно пропуская через нее воздух с помощью резиновой груши. Для того чтобы осела летучая пыль из обжигового газа, отведем его в пустой стеклянный сосуд, а из него — во вторую тугоплавкую трубку, в которой находится катализатор, нагретый до 400—500 °С. В технике чаще всего в качестве катализатора используют оксид ванадия (V) V2O5 или ванадат натрия NaVO3, а мы для этой цели применим красный оксид железа (III) Fe2О3. Нанесем мелкоизмельченный оксид железа на стеклянную вату, которую распределим в трубке слоем Длиной 5 см. Трубку с катализатором нагреем до начала красного каления. На катализаторе оксид серы (IV) взаимодействует с кислородом воздуха; в результате образуется оксид серы (VI)
2SO2 + O2 = 2SO3
который мы различим по его способности образовывать туман во влажном воздухе. Соберем SO2 в пустой колбе и, сильно отряхивая, смешаем с небольшим количеством воды. Получим серную кислоту — ее наличие докажем, как и в предыдущем способе.
Можно также поместить разделенные стеклянной ватой и катализатор в одну из стеклянных трубок. Можно работать и в пробирке с боковым отводом. Положим на пробирки пирит, на него слой стеклянной ваты, а затем стеклянную вату с катализатором. Воздух введем сверху в трубку, которая должна подходить вплотную к катализатору. На боковом отводе укрепим согнутую под углом трубку, которая ведет в пробирку.
Если нет пирита, то в пробирке с боковым отводом получим оксид серы (IV) из сульфита или гидросульфита натри серной кислоты, и затем пропустим над катализатором полученный газ вместе с потоком воздуха или кислорода. В качестве катализатора можно применить также оксид хрома (Ш) который следует прокалить в железном тигле и тонко растолочь в ступке. Для этой же цели можно пропитать раствором су фата железа (II) глиняный черепок и затем сильно прокалить его. На глине при этом образуется тонкий порошок оке железа (III).
Кислота из гипса
Если сульфидов металлов мало (как, например, в Германии) исходными продуктами для получения серной кислоты может служить ангидрит CaSO4 и гипс CaSO4-H2O. Метод получения оксида серы (IV) из этих продуктов был разработан Мюллером и Кюне еще 60 лет, назад.
Способы получения серной кислоты из ангидрита будут иметь значение и в будущем, так как серная кислота является самым распространенным химическим продуктом. Сульфаты можно разложить, применяя высокую (до 2000 °С ) температуру. Мюллер установил, что температуру разложения сульфата кальция можно снизить до 1200 °С, если добавить тонкоизмельченный кокс. Сначала, при 900 °С, кокс восстанавливает сульфат кальция до сульфида, а тот в свою очередь при температуре 1200 °С взаимодействует с неразложившимся сульфатом; при этом образуется оксид серы (IV) и негашенная известь:
CaSO4 + 2C = CaS + 2CO2
CaS + 3CaSO4 = 4CaO + 4SO2
Разложить сульфат кальция в лабораторных условиях удастся только при применении соответствующей высокой температуры. Будем работать с аппаратурой, подобной той, какая была использована при обжиге пирита, только трубку для сгорания возьмем фарфоровую или железную. Закрой трубку пробками, обернутыми для теплоизоляции асбестовой тканью. В отверстие в первой пробке вставим капилляр, а во второй—простую стеклянную трубку, которую соединим : промывной склянкой, наполненной наполовину водой или раствором фуксина.
Реакционную смесь приготовим следующим образом. Растолчем в ступке 10 г гипса, 5 г каолина (глина) и 1,5 г активного порошкообразного угля. Смесь высушим, нагревая некоторое время при 200 °С в фарфоровой чашке. После охлаждения (лучше всего в эксикаторе) внесем смесь в середину трубки для сжигания. При этом обратим внимание на то, чтобы она не заполнила все поперечное сечение трубки. Затем сильно нагреем трубку с помощью двух горелок (одна снизу, вторая наклонно сверху) и, когда трубка накалится, пропустим через всю систему не слишком сильный поток воздуха. Уже через 10 минут, благодаря образованию сернистой кислоты, раствор фуксина в промывной склянке обесцветится. Выключим водоструйный насос и прекратим нагревание.
Получить высокую температуру мы можем также, если обмотаем как можно плотнее фарфоровую трубку нагревательной спиралью на 750—1000 Вт (см. рисунок). Концы спирали соединим с толстой медной проволокой, которую также многократно обмотаем вокруг трубки, а затем изолируем с помощью фарфоровых бусинок и подведем к штекеру. (Осторожно при работе с напряжением 220 В!) Естественно, в качестве источника нагрева может пригодиться также стеклодувная горелка или паяльная лампа.
В технике работают со смесью ангидрита, кокса, глины, песка и колчеданного огарка Fe2O3. Червячный транспортер сдает смесь в 70-метровую вращающуюся трубчатую печь, где сжигают пылевидный уголь. Температура в концевой части печи, в месте горения, составляет примерно 1400 °С. При этой температуре образующаяся в ходе реакции негашеная известь сплавляется с глиной, песком и колчеданным огарком в результате получается цементный клинкер. Остывший клинкер размалывают и смешивают с несколькими процентами гипса. Получившийся в результате высококачественный портландцемент поступает в продажу. При тщательном проведении и контроле процесса из 100 т ангидрита (плюс глина, песок, kокс и колчеданный огарок) можно получить около 72 т cepной кислоты и 62 т цементного клинкера.
Серную кислоту можно получать также из кизерита (сульфата магния MgSO4 -Н2О).
Для опыта воспользуемся такой же установкой, как и для разложения гипса, но трубку на этот раз возьмем из тугоплавкого стекла. Реакционную смесь получим, прокалив в фарфоровой чаше 5 г сульфата магния, а в железном тигле с крышкой—0,5 г активного угля, и затем смешав их и растет в ступке до пылеобразного состояния. Перенесем смесь в фарфоровую лодочку и поместим ее в реакционную трубку.
Белая масса, которая получится в конце опыта в фарфор вой лодочке, состоит из оксида магния. В технике его перерабатывают в цемент Сореля, являющийся основой для производства ксилолита.
Получение таких важных для строительной промышленности производных продуктов, как цементный клинкер и ксилолит, делает производство серной кислоты из местного сырья особенно экономичным. Переработка промежуточных и побочных продуктов в ценное сырье или конечные продукты является важным принципом химической промышленности.
Получим ксилолит
Смешаем равные части оксида магния и опилок с растворе хлорида магния и слой образовавшейся кашицы толщине около 1 см нанесем на подложку. Через 24—48 ч масса затвердеет, как камень. Она не горит, ее можно сверлить, пилить прибивать гвоздями. При строительстве домов ксилолит применяют как материал для полов. Древесное волокно, затвердевшее без заполнения промежутков с цементом Сореля (магнизиальным цементом), спрессованное и склеенное в плиты используется в качестве легкого, тепло- и звуконепроницаемого строительного материала (плиты Гераклита).
2i.SU ©® 2015