Химия
Опыты для дома
Азот
Аммиачный фонтан
Аммиак – бесцветный газ. Он раздражает дыхательные пути, а в больших концентрациях ядовит. Аммиак легче воздуха и чрезвычайно хорошо растворяется в воде, и в этом мы сейчас убедимся на опыте.
Из продажного 25%-ного раствора аммиака (гидроксида аммония NH4OH, нашатырного спирта) выделим при нагревании аммиак, который соберем в сухую круглодонную колбу. (Ни в коем случае нельзя использовать плоскодонную или эрленмейеровскую колбу! Эти сосуды не выдерживают вакуума и взрываются. Для этого опыта удобно также использовать нижние части склянок для промывания газов.) Затем закроем колбу резиновой пробкой, в отверстие которой вставлена оттянутая на конце стеклянная трубка. Большой химический стакан наполним водой с несколькими каплями фенолфталеина.. Многократно погружая горлышко колбы в этот раствор, попытаемся ввести внутрь колбы через трубку несколько капель воды. Благодаря большой растворимости аммиака (в 1 объеме воды при 20 °С растворяется 702 объема аммиака) большая часть газа растворится. В колбе возникнет разрежение, и внешнее давление воздуха выбросит с большой силой воду из химического стакана в колбу. Красная окраска индикатора в колбе указывает на наличие там основной среды.
Получим азотную кислоту
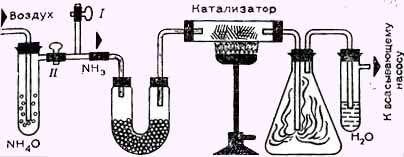
С помощью каталитического окисления (метод Оствальда) можно перевести аммиак в азотную кислоту. На химическом комбинате Биттерфельд, смесь аммиака и воздуха с большой скоростью пропускают над платинокобальтовым катализатором. Возникающий при этом бесцветный монооксид азота NO сначала превращается на воздухе в коричневый диоксид азота NO2, а затем при действии кислорода и воды —в азотную кислоту
4NH3 + 5O2 = 4NO + 6H2O
4NO + 2O2 = 4NO2
4NO2 + O2 + 2H2O = 4HNO3
Мы же соберем установку, изображенную на рисунке. Для того, чтобы приготовить катализатор, добавим по каплям раствор хлорида железа (III) к раствору гидроксида аммония. При этом выпадает коричневый осадок гидроксида железа (III). Отфильтруем его, промоем на фильтре холодной водой, смешаем сырую еще массу с асбестом (можно отщипнуть волокна от подставки под утюг, использовать кусочек асбестового шнура и т. п.) и сильно прокалим массу. При этом на асбесте выделится оксид железа (III).
Пропустим сначала через установку поток воздуха (кран I открыт, кран II закрыт) с помощью водоструйного насоса (в крайнем случае достаточно применить для отсоса воздуха резиновый вентилятор) и сильно нагреем катализатор. Затем закроем кран I и откроем кран II. Поток воздуха увлекает аммиак, который после сушки в U-образной трубке с негашеной известью СаО окисляется на катализаторе с образованием оксида азота. А он, взаимодействуя в конической колбе (так называемая колба Эрленмейера) с кислородом воздуха, превращается в диоксид. Наконец, в пробирке с боковой насадкой образуется азотная кислота. Хотя она очень разбавлена, мы можем обнаружить кислую среду с помощью лакмусовой бумажки, а наличие нитрат-ионов —как описано в разделе “Аналитическая химия”.
Азотная кислота —бесцветная, очень едкая жидкость. Концентрированная кислота, 69,2%-ная HNO3 с плотностью 1,41 г/м3, относительно легко отдает кислород. Поэтому она является сильным окислителем. Благодаря этому свойству она растворяет различные неактивные металлы, такие как медь, ртуть и серебро. Золото она не разрушает, поэтому можно отделить золото от серебра с помощью азотной кислоты. Однако смесь одной объемной части концентрированной азотной кислоты и трех объемных частей соляной кислоты — царская водка — растворяет и золото и платину.
Если мы хотим получить азотную кислоту более высокой концентрации, то смешаем в реторте 56 г сухой тонкораспыленной калийной селитры KNO3 с 32 мл концентрированной серной кислоты и перегоним получившуюся кислоту в хорошо охлаждаемый сборник. Если реторта с тубусом, закроем его корковой пробкой, обернутой алюминиевой фольгой. Горло реторты опустим как можно глубже в сборник, который будем охлаждать в стакане с ледяной водой или в проточной водопроводной воде. Для этой цели поместим сборник в воронку и укрепим над ретортой шланг, в который подается холодная вода. Из воронки с помощью шланга отведем холодную воду в ведро или раковину. На окончание опыта укажет выделение коричневых ядовитых паров NO2:
2KNО3 + H2SO4 = К2SO4 + 2НNО3
Раньше азотную кислоту только таким методом и получали. Исходным продуктом служил встречающийся в Чили в больших количествах нитрат натрия NaNO3 (натриевая, или чилийская селитра).
2i.SU ©® 2015