Физика
Новости физики
Новости науки 26.06.02. Новый подход к лечению лимфоидных опухолей.
В процессе эволюции млекопитающие выработали две основные стратегии защиты от неконтролируемых опухолевых процессов - клеточный иммунитет, с помощью которого распознаются и удаляются собственные клетки, несущие определенные опухоль-ассоциированные антигены (предполагают, что эта линия защиты эффективна в первую очередь в отношении клеток, зараженных опухолеродными вирусами) и процесс программированной клеточной гибели (ПКГ) или апоптоза. Апоптоз - это многостадийный внутриклеточный процесс переноса сигнала, результатом которого является разрезание важных для клетки белков и ДНК и клеточная смерть. В норме программа ПКГ должна запускаться автоматически при попытке клетки выйти из-под контроля внешних или внутренних факторов, контролирующих процесс старения (дифференцировки) и/или интенсивность клеточного деления. Этот процесс может блокироваться в ходе образования опухоли (канцерогенеза, от лат. канцер - рак + греч. генезис - развитие). Основная стратегия лечения опухолей, в том числе и лимфоидных, состоит в попытке селективно воздействовать на опухолевые (трансформированные) клетки и запустить в них "дремлющий" процесс ПКГ. В большинстве случаев этого пытаются достичь при помощи рентгеновского облучения и химиотерапии специфическими веществами - цитостатиками, имеющих повышенное сродство к клеточным компонентам, содержание которых повышено в интенсивно пролиферирующих (а значит и в опухолевых) клетках. Конечной целью таких терапевтических воздействий является повреждение ДНК, которое стимулирует запуск апоптоза в опухолевой клетке.
Однако данный подход имеет ряд недостатков, в первую очередь неспецифичность (повреждаются нормальные клетки - предшественники и стволовые клетки, обладающие высоким пролиферативным потенциалом), высокую токсичность и способность вызывать мутации, которые в итоге способствуют выходу опухоли из-под терапевтического контроля. Кроме того, опухолевая клетка имеет богатый арсенал возможностей для "обхода" или ингибирования терапевтически-индуцированной апоптотической программы. В результате множество типов лимфоидных опухолей остаются на данный момент неизлечимыми либо слабо поддающимися терапии. Среди них и миеломная болезнь, которая развивается исключительно в костном мозге и заканчивается летально в 100% случаев. Сказанное выше предполагает необходимость поиска новых нестандартных, более специфичных и менее опасных для здоровья подходов к лечению опухолей крови (гемобластозов).
Клетки лимфоидной ткани размещаются и проходят свое развитие в специфических органах, основными из которых являются костный мозг, селезенка и лимфатические узлы. Данные органы состоят из лакун (ниш), заполненных клеточными и неклеточными (белки, модифицированные углеводными остатками) элементами. Весь комплекс окружения, в котором проходит жизнь лимфоидных клеток, называют стромой.
Тот факт, что рост и локализация (специфическое место роста) лимфоидных клеток контролируются веществами, секретируемыми клетками стромы, известен с начала 90-х годов, однако молекулярные механизмы данных взаимодействий и их роль в патогенезе опухолевого роста стали проясняться сравнительно недавно. Показано, например, что продукция таких цитокинов (сигнальных молекул лимфоидной системы), как интерлейкин-6 (ИЛ-6), VEGF (Vascular Endothelial Growth Factor), HGF (Hepatocyte Growth Factor) и TNF-альфа значительно усиливается при контакте клеток опухоли со стромальными клетками.
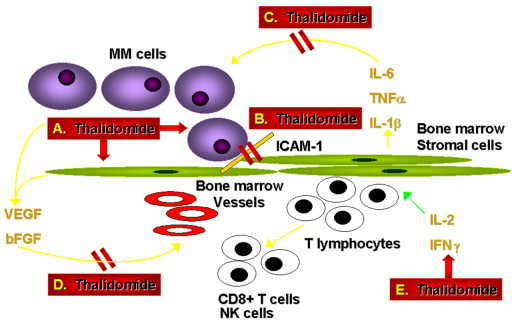
Основные механизмы лечебного действия талидомида (thalidomide) на рост миеломы. MM cells - миеломные клетки; bone marrow - костный мозг (КМ); vessels - сосуды КМ. Талидомид блокирует прикрепление и обмен цитокинами (зачеркнуто двумя красными линиями).
Ученые из Dana Farber Cancer Institute (Бостон, США) исследовали in vitro (т.е. "в пробирке") механизмы противоопухолевого действия ряда препаратов (талидомид (thalidomide), PS-341 и ряд других), которые проявили эффективность в случаях миеломы, устойчивой к стандартной терапии. Они выяснили, что назначение данных лекарств, кроме прямого действия на клетки опухоли, приводит к блокированию синтеза некоторых цитокинов - стимуляторов опухолевого роста, таких как ИЛ-6 и VEGF [1]. Так как данные цитокины также оказывают защитное действие при попытке запуска апоптоза с помощью кортикостероидного препарата дексаметазона, их блокада приводит к реверсии (возвращению в норму) чувствительности к дексаметазону [2]. Кроме того, в результате действия талидомида и PS-341 нарушается способность опухолевых клеток активно прикрепляться к клеткам стромы костного мозга (см. рис.), что, как полагают авторы, также вносит вклад в эффективность лечения. Ожидается, что особенно чувствительны к препаратам данной группы будут больные, у которых в результате произошедших хромосомных перестроек усилен синтез интерлейкина-6 и VEGF в миеломных клетках.
Таким образом, найден новый эффективный путь борьбы с миеломой - с помощью блокирования клеточно - стромальных взаимодействий. Определяется возможность применения данного подхода для лечения других форм лимфом и лейкемий.
1. Hideshima T, Chauhan D, Podar K et al. Novel therapies targeting the myeloma cell and its bone marrow microenvironment. Semin. Oncol., v. 28, p. 607, (2001).
2. Mitsiades N, Mitsiades CS, Poulaki V et al. Apoptotic signaling induced by immunomodulatory thalidomide analogs in human multiple myeloma cells: therapeutic implications. Blood, v. 99, p. 4525, (2002).
2i.SU ©R 2015