Физика
Механика
Энтропия
Мы уже знаем, как было открыто первое начало термодинамики. На опыте была обнаружена независимость разности поглощенного системой тепла и совершенной ею работы от того, какие круговые процессы происходили в системе. Это и стало доказательством того, что в мире существует замечательная величина, свойственная любой системе, любому веществу, любому телу, — внутренняя энергия. Она определяется только состоянием системы и не зависит от того пути, по которому система в это состояние пришла.
Запомним это и снова вернемся ко второму началу термодинамики. Значение к.п.д. обратимой тепловой машины, работающей с любым веществом (т. е. величину, показывающую, какую долю затраченного тепла мы можем превращать в работу), можно выразить формулой
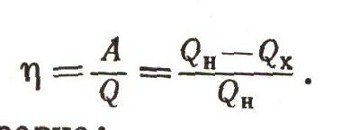
Эта величина равна:
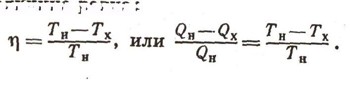
В науке часто несложные, простые арифметические действия приводят к большим и важным выводам. Относитесь к ним с уважением — такие действия, несмотря на их простоту, иногда раскрывают большую научную перспективу.
Вам сейчас придется внимательно проследить за преобразованием выражения для к.п.д. Оно преобразуется очень просто. Конечно, это выражение можно переписать так :
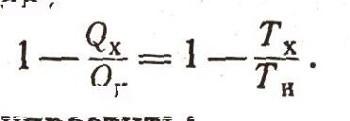
Затем его можно упростить:
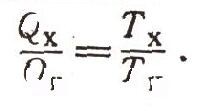
Полученную пропорцию лучше переписать так:
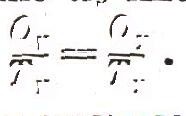
Не забывайте, что индексом «н» обозначены тепло, взятое у нагревателя, и его температура, а индексом «х»—тепло, отданное холодильнику, и, соответственно, его температура.
И наконец, можно написать:
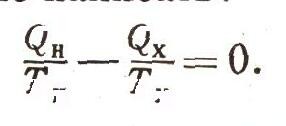
Учтем, что мы условились считать тепло, которое система получает, положительным, а то тепло, которое она отдает, — отрицательным. Ясно, что этот результат представляет собой алгебраическую сумму отношений теплоты и соответствующей температуры. Для обратимого цикла Карно эта сумма оказалась равной нулю:
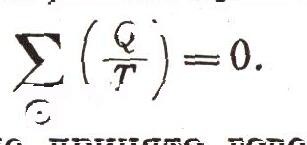
В термодинамике принято говорить: сумма приведенных теплот для обратимого цикла Карно равна нулю. Оказывается, что это справедливо и для любого обратимого, т. е. квазистатического, цикла, каким бы сложным он ни был. Это замечательный результат, один из наиболее важных для всего естествознания.
Из него сейчас же следует очень важный вывод: для любой системы и для любого незамкнутого процесса, каким бы он ни был, из скольких бы стадий ни состоял, обязательно должно существовать такое особое свойство системы, изменение которого при переходе из одного состояния в другое равно сумме приведенных теплот.
Это, конечно, не очень понятно; не так уж легко представить себе, о чем тут идет речь, а наглядно это свойство вообразить вряд ли удастся. Но тем не менее такое свойство действительно существует в природе, оно играет важнейшую роль не только в в термодинамике, но и во всем естествознании, включая даже философию. Это свойство принято обозначать буквой S. Его изменение при переходе системы из одного состояния в другое равно:
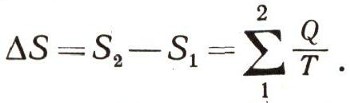
Открыл его немецкий ученый, знаменитый термодинамик Р. Клаузиус. Это уравнение носит его имя. Обнаружив в природе новую, ранее не известную никому величину, Клаузиус назвал ее странным и непонятным словом «энтропия», которое сам и придумал. Он так объяснил его значение: «тропе» по-гречески означает «превращение». К этому корню Клаузиус добавил две буквы — «эн», так, чтобы получившееся слово было бы по возможности подобно слову «энергия». Обе величины настолько близки друг другу своей физической значимостью, что известное сходство в их названиях было целесообразно.
Открытие второго начала термодинамики позволило обнаружить в природе новое замечательное свойство — энтропию, подобно тому как первое начало термодинамики привело к открытию точного понятия «внутренняя энергия».
Можно ли обнаружить энтропию!
К сожалению, никак нельзя. Человек не обладает такими органами чувств, которые давали бы ему возможность «видеть» непосредственно, «много» или «мало» энтропии содержит система.
Но, пожалуй, ни сожалеть, ни удивляться по этому поводу не следует. Ведь мы, например, привыкли к «простому» понятию «энергия». Но до того, как раздастся выстрел, трудно судить по внешнему виду пороха в ружейном заряде, велик ли запас его внутренней энергии.
2i.SU ©® 2015