Физика
Механика
Основные понятия термодинамики. Системы, которые исследует термодинамика
Каждая наука, и термодинамика также, изучает свои определенные области, ограничивая их и выделяя из необозримой сложности и многообразия всей совокупности бесчисленных процессов, протекающих в действительности. Этим упрощается задача познания неизвестного. Иначе ни одна наука не могла бы развиваться.
Термодинамика изучает состояние системы - некоторого определенного количества вещества. Что такое термодинамическая система? Каковы ее свойства? Что называется состоянием системы? Ответить на эти вопросы лучше всего конкретными примерами. Для термодинамика, изучающего химические реакции, системой будет та смесь многих реагирующих веществ в его приборе, где и протекают сложные химические превращения. Ученый-астрофизик назовет системой внутренность гигантской звезды того класса, который он изучает. Залив моря, где происходят кристаллизация и выделение солей из морской воды,- это тоже система для ученых, изучающих с точки зрения термодинамики солевые равновесия.
Перегретый водяной пар в рабочем колесе паровой турбины, взрывчатая газовая смесь паров горючего с воздухом в цилиндре двигателя автомашины, пары сверхвысокого давления в котельном агрегате тепловой электростанции - все это различные системы, свойства и состояния которых изучаются термодинамикой.
Не следует думать, что системы, которые ученые изучают методами термодинамики, обязательно должны быть ограничены реальными твердыми стенками, например бронированными стенками колонн, в которых проводится синтез при высоком давлении на химическом заводе, стенками стеклянной колбы в лаборатории химика, стенками стального цилиндра в двигателе паровой машины или парового насоса.
Исследователь может выделить изучаемую им систему воображаемыми мысленно границами: он может рассматривать образование облака в атмосфере, процессы, происходящие в живой клетке организма, состояние вещества внутри звезды, следить за процессами, протекающими в трубах реактора сложнейшего химического производства.
Система не может быть бесконечной
Термодинамика может изучать любые системы, но одно условие обязательно: система должна быть конечной. Она может быть ничтожно малой, такой, как, например, живая клетка, может быть гигантски большой, как звезда.
Ее законы нельзя распространять не только на всю бесконечную Вселенную, но даже и на значительные области Вселенной, поскольку процессы в них в сильной степени определяются полями тяготения. Размеры систем, для которых применимы законы термодинамики, не могут быть и очень малыми. Эти законы утрачивают смысл для систем, состоящих всего из нескольких молекул.
Состояние и свойства системы
Состояние системы определяется температурой, давлением и объемом. Эти свойства системы хорошо всем знакомы, но они далеко не простые. Состояние водорода, водяного пара, любого газа, воды, любой жидкости, кристалла, самой сложной смеси реагирующих веществ полностью характеризуется соответствующими значениями свойств системы. Иногда ученому-термодинамику приходится принимать во внимание, учитывать и внешние воздействия на систему, от которых может зависеть ее состояние: силу тяжести (например, при изучении свободной атмосферы), электрические или магнитные поля.
Состояние системы - это совокупность ее свойств. Изменилось состояние системы - изменились и значения ее свойств. Восстановилось снова прежнее состояние - восстановились прежние значения ее свойств. На настоящем состоянии системы ее прошлые состояния не отражаются. Вода остается той же самой водой, если ее заморозить, а потом растопить лед или сначала испарить воду, а потом сконденсировать пар. Изменение свойства не зависит от пути перехода системы из начального состояния в конечное. Очень важно, что справедливо и обратное утверждение: если при переходе системы из одного состояния в другое изменение некоторой величины не зависит от пути перехода, а определяется только начальным и конечным состояниями системы, то эта величина - свойство системы.
Вероятно, у многих может возникнуть вопрос: зачем нужно говорить о простых вещах так неопределенно, туманно и неясно? Если ученый изучает воду, так пусть он ее водой и называет.
Дело в том, что термодинамика очень экономная наука. Если термодинамика дает уравнение для расчета химической реакции, то оно справедливо не только для какой-нибудь одной реакции, но и для всех химических реакций, где бы они ни протекали, кем бы ни проводились, при каких бы условиях ни осуществлялись и какие бы вещества в этих реакциях ни принимали участие. Непреложные термодинамические законы о превращениях энергии в тепловых машинах применимы ко всем тепловым двигателям, как бы они ни были построены, на каком бы принципе они ни работали, даже и к тем тепловым машинам, которые когда-нибудь будут изобретены. Поэтому гораздо правильнее и точнее эту замечательную особенность термодинамики выразить так: она изучает состояния и свойства термодинамической системы вообще, любой, какой угодно.
Уравнение состояния
И химику, и теплотехнику, и физику, и конструктору новых космических кораблей мало знать общие закономерности поведения системы вообще. Им нужно рассчитывать конкретные задачи.
Для этого нужно знать уравнение состояния вещества. Его нельзя получить при помощи термодинамики. Оно должно быть найдено независимым путем: точными измерениями или теоретически. Уравнение состояния необходимо термодинамике знать заранее, без него она ничего не может рассчитать. Оно позволяет рассчитать для определенного вещества любую из четырех важнейших величин — количество вещества (т), его объем (v), давление (р) или температуру (Т), если известны три остальные величины:
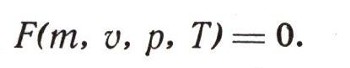
Удобнее рассматривать один моль газа, тогда v в уравнении состояния означает мольный объем, т. е. объем одного моля вещества:
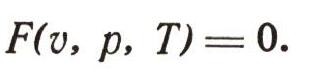
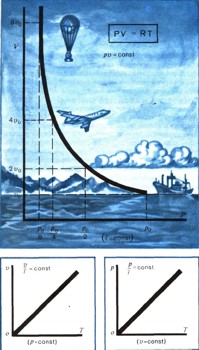
Каждый школьник знает уравнение состояния идеальных газов, его вывел впервые петербургский профессор француз Б. Клапейрон:
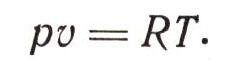
Это уравнение хорошо описывает поведение одного моля любого газа при малых давлениях и высоких температурах. Оно очень простое, что сильно облегчает расчеты, и достаточно точное, поэтому его очень часто применяют. Этому замечательному уравнению подчиняются и воздух, которым мы дышим, и раскаленные газы в топках, и плазма внутри звезды, и даже электроны в металле. Выведено оно при допущении, что молекулы газа представляют собой материальные точки: обладают массой, но не имеют объема и никак не взаимодействуют между собой. Поэтому оно и названо уравнением состояния идеальных газов.
Такое допущение определяет область, в которой применяется это уравнение: при низком давлении газ занимает настолько большой объем, что объемом самих молекул можно смело пренебречь, а при высокой температуре молекулы обладают такой большой энергией и такой большой скоростью, что взаимное притяжение не влияет на их движение.
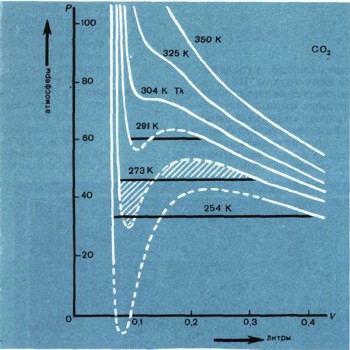
Конечно, в действительности нельзя пренебрегать ни собственными размерами молекул, ни их взаимным притяжением. Истинный свободный объем, в котором могут двигаться молекулы (и — b), будет меньше объема газа (и), так как часть этого объема (b) занимают молекулы, а давление, под которым находится газ, несколько больше внешнего давления, потому что из-за межмолекулярного притяжения газ испытывает как бы дополнительное сжатие:
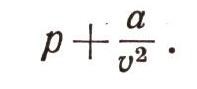
Поправка к давлению должна быть тем больше, чем ближе друг к другу находятся молекулы в газе, чем более он сжат, чем меньший объем занимает.
Эта поправка ( a/u2 ) обратно пропорциональна квадрату объема: чем он меньше, тем ближе друг к другу молекулы и тем больше притяжение, а кроме того, самих молекул в единице объема больше.
Эти поправки ввел в уравнение идеального газа голландский ученый Я. Ван-дер-Ваальс. Он предложил уравнение
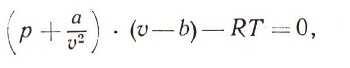
которое называется его именем или уравнением реальных газов. R здесь постоянная, которая зависит от количества газа. Это уравнение более точно, чем уравнение Клапейрона, и применимо в значительно более широких пределах при изменении температуры и давления. Поправки а и b определяются из опытных данных. Изучив отклонения от идеального газа в изменении объема газа при сжатии, можно даже довольно точно оценить размеры его молекул.
Знать уравнение состояния очень важно для термодинамики, без него она бессильна при всем своем могуществе. Кроме двух приведенных уравнений состояния были предложены десятки, а может быть, даже и сотни различных форм уравнений состояния, описывающих поведение различных веществ с возможно большей степенью точности. Таким образом, в совокупности свойств, характеризующих состояние системы, нельзя произвольно менять значение всех свойств. Эти значения связаны между собой уравнением.
Процесс
Изменение состояния системы называется процессом. Это очень широкое и очень важное понятие. В теплое утро влажный воздух над озером, нагретый лучами солнца, высоко поднялся над землей и, расширившись, охладился; влага, находившаяся в нем, начала конденсироваться - мы наблюдаем процесс образования облака. В печи весело потрескивают дрова, согревая комнату, - это процесс химической реакции соединения с кислородом. Гигантский взрыв на выброс, за тысячные доли секунды он прокладывает десятки километров нового канала, - это тоже процесс: химическая реакция разложения взрывчатки и последующее расширение образовавшихся при реакции газов.
Образование перегретого пара высокого давления в паровом котле, его расширение в паровой турбине, охлаждение в конденсаторе - все это процессы, обеспечивающие работу сверхмощной электростанции.
Окружающая среда
Системы, которые изучает термодинамика, хотя и содержат определенную и постоянную массу вещества, совсем не изолированы от окружающего мира. Чтобы в реакторе химика могла успешно протекать нужная ему реакция, он должен предусмотреть, каким способом будет нагреваться или, наоборот, охлаждаться реакционный аппарат. Пар, расширяясь в цилиндрах паровоза, движет поршень, это движение передается на колеса, и тяжелый состав отправляется в путь. Воздух, нагретый у земной поверхности лучами солнца, поднявшись вверх, расширяется и раздвигает слои атмосферы на большой высоте, где давление понижено, - образуется облако.

Термодинамика изучает процессы, в которых система не обменивается веществом с окружающей средой, но может обмениваться теплотой и работой. Такая система называется закрытой. Как предельный случай система может быть полностью изолирована от окружающего мира и не обмениваться с ним ни веществом, ни работой, ни теплотой.
Наиболее важные процессы
Среди множества разнообразных процессов некоторые, наиболее простые, имеют особо важное значение для термодинамики. Из них здесь необходимо упомянуть два вида термодинамических процессов:
1. Те, которые протекают при постоянной температуре, носят название изотермических. Таких процессов и в природе, и в технике очень много. Изотермически, например, тает лед, вода превращается в пар, углекислый газ - в сухой лед. Почти все процессы в живом организме протекают при постоянной температуре.
2. Те процессы, которые протекают без обмена теплом с окружающей средой, называются адиабатическими. Часто адиабатическим путем протекают очень быстрые процессы, когда система не успевает обменяться теплом с окружающей средой.
Если вы заставите расшириться газ, помещенный в термос, ему придется расширяться адиабатическим путем. При этом газ охладится. Один французский рабочий-оружейник придумал в 1803 г., когда еще не были изобретены спички, "воздушное огниво" - закрытую с одного конца трубку с поршнем. Очень быстрое и сильное сжатие воздуха в "воздушном огниве" приводит газ в раскаленное состояние, и трут, прикрепленный к поршню, воспламеняется. Это тоже адиабатический процесс.
Конечно, и при изотермических, и при адиабатических процессах система взаимодействует с окружающей средой. При изотермических процессах система, совершая работу или изменяя состояние, поглощает из окружающей среды теплоту - ровно столько теплоты, что температура внутри системы остается постоянной. При адиабатических процессах система взаимодействует с окружающим миром, только совершая работу.
Температура
Ощущения тепла и прохлады, жары и холода присущи человеку и играют большую роль в его жизни. Однако понятие температура - трудное и тонкое понятие. Историю термодинамики, собственно говоря, можно начать с изобретения Г. Галилеем в 1592 г. простого устройства - термоскопа. Человечество должно быть глубоко благодарно Галилею за его гениальную идею - судить об изменениях температуры по изменениям других свойств тела. Сам Галилей предложил измерять температуру по расширению воздуха. В его первом термоскопе показания искажались изменением барометрического давления. Вскоре был изобретен газовый термоскоп постоянного объема, он оказался значительно более чувствительным и более точным.

Вместо воздуха трубку стали заполнять жидкостью: сначала водой, потом спиртом и, наконец, ртутью. Ртуть оказалась настолько удобной, что один физик XVIII столетия заявил в порыве восторга: "Определенно, природа создала ртуть для изготовления термометров..."
Триста лет назад флорентийские академики открыли, что в смеси воды и льда температура постоянна. Спустя 50 лет стеклодув Д. Фаренгейт установил, что температура кипения воды остается постоянной, если давление не меняется. Эти две постоянные температурные точки дали возможность прокалибровать термоскоп, что и превратило его в термометр.
Первое время, чтобы измерять высоту столбика жидкости, расширяющейся при нагревании, делили расстояние между двумя точками - от точки плавления льда до точки кипения воды - на произвольное число равных частей. В 1742 г. А. Цельсий предложил делить расстояние между этими точками ровно на сто частей. Он обозначил температуру плавления льда как сто градусов, а температуру кипения воды как нуль градусов. Но вскоре эти обозначения поменяли местами. Этой шкалой пользуются уже более 200 лет почти во всем мире. Она удобна, проста и практична.
Что же показывает термометр!
Кажется, что это всем ясно - температуру! А что такое температура?
Очень хорошо сказал по этому поводу один физик: "Гораздо легче производить измерения, чем точно знать, что измеряется". И почти три сотни лет измеряли повсюду температуру, но только совсем недавно, в конце прошлого столетия, стало окончательно ясно, что такое температура.
А в самом деле, что же показывает термометр? Стоит еще раз проследить, как возникло понятие "температура". Когда-то думали: если становится жарко, то это потому, что в теле повышается содержание теплорода. Латинское слово "температура" означало "смесь". Под температурой тела понимали смесь из материи тела и теплорода тела. Затем понятие самого теплорода было отброшено как ошибочное, а слово "температура" осталось.
Добрые две сотни лет в науке сохранялось странное положение: случайно выбранным свойством (расширение) случайно выбранного вещества (ртуть) и шкалой, установленной по случайно выбранным постоянным точкам (плавление льда и кипение воды), измерялась величина (температура), а смысл слова "температура", строго говоря, никому не был понятен. Но ведь термометр все-таки что-то показывает? Если от ответа потребовать необходимую строгость и точность, то на такой вопрос придется ответить так: ничего, кроме удлинения в столбике нагретой ртути.
Ну а если ртуть заменить другим веществом: газом или каким-либо твердым телом, которое также расширяется при нагревании, - что будет тогда? Что будут показывать построенные на иной основе термометры?
Представим себе, что такие термометры мы сделали. Одни из них мы заполнили ртутью, воздухом, другие изготовили целиком из железа, меди, стекла. Точно установим на каждом термометре постоянные точки: в тающем льду 0° С, в кипящей воде 100° С. Попробуем теперь измерять температуру. Окажется, что, когда воздушный термометр покажет, например, 300° С, другие термометры будут показывать : ртутный 314,1° С железный 372,6° С медный 328,8° С стеклянный 352,9° С
Какая же из этих "температур" правильна: "воздушная", "ртутная", "железная", "медная" или "стеклянная"? Ведь каждое из испытанных нами веществ показывает свою собственную температуру. Еще интереснее повел бы себя "водяной" термометр. В пределах от 0 до 4° С он показывал бы при нагревании понижение температуры.
Можно, конечно, попытаться выбрать вместо теплового расширения какое-нибудь другое свойство вещества, изменяющееся при нагревании. Можно, например, построить термометры на основе изменения (при нагревании) давления пара жидкости (на-пример, спирта), изменения электрического сопротивления (например, платины), термоэлектродвижущей силы (термопара). В наше время такие термометры широко применяются в технике.
При условии предварительной калибровки по двум постоянным точкам такие термометры, например, при 200° С будут показывать: спиртовой (по давлению пара) -1320° С, платиновый (по сопротивлению) - 196° С, спай платины и сплава ее с родием (термопара) - 222° С. Так какая же из всех этих разных "температур" настоящая? Как и чем нужно измерять температуру? Прежде чем ответить на эти вопросы, следует уяснить себе самое важное в них - их точное содержание и смысл: "Чем нужно измерять температуру?" Почему такой "простой" вопрос вообще может возникать?
В каких единицах мы измеряем длину? В метрах. В чем мы измеряем объемы? Можно измерять в литрах. Литр - это объем, равный, одному кубическому дециметру. А чем мы измеряем температуру?
Эти вопросы совершенно сходны, но ответы на них принципиально различны. Если мы сольем в бочку несколько ведер холодной воды, то бочка будет заполнена водой. Сумма объемов воды в ведрах будет равна объему бочки. Но сколько бы холодной воды вы ни влили в бочку, горячей воды при этом не получится. Рассуждение это совсем не смешно и не наивно, и факт этот вовсе не очевиден сам собой. Это очень важный закон природы, к которому мы просто привыкли, потому что знаем его из опыта. Из нескольких коротких палок можно составить одну длинную, соединив их между собой встык. Но нельзя сложить температуру раскаленного угля из печи и температуру куска льда. Раскаленный уголь от этого не станет более горячим.
Измерять температуру, подобно тому как измеряют длину, объем, массу, нельзя потому, что температуры не складываются. Невозможна такая единица температуры, которой можно непосредственно измерять любую температуру, подобно тому как метром измеряют любую длину. Объем, длина, масса - примеры экстенсивных (количественных) свойств системы. Если железный стержень разделить на несколько частей, температура каждой из них от этого не изменится. Температура - пример интенсивных (качественных) свойств системы. Непосредственно установить числовое соотношение между различными температурами невозможно и бессмысленно.
Но ведь измерять температуру необходимо. Так как же ее измерять, если ее нельзя измерить методом, пригодным для измерения экстенсивных величин? Для этого возможен только один путь - использовать объективную связь между температурой и любой экстенсивной величиной: изменением объема, длины, отклонением стрелки гальванометра и т. п.
Поэтому ответ на вопрос: "Какая из перечисленных выше различных "температур" настоящая?" -может показаться с первого раза странным: все они равноправны. Любое свойство системы, зависящее от температуры, может быть выбрано для ее характеристики и измерения.
Термодинамика сумела указать способ и вещество, которое позволяет осуществить температурные измерения наиболее целесообразно. Это идеальный газ. По его расширению при постоянном давлении или по росту давления при постоянном объеме могут быть проведены наиболее целесообразно измерения температуры. При таком способе измерения бесчисленные выражения для любых закономерностей в природе становятся наиболее простыми. Но у идеального газа есть один существенный недостаток : такого газа нет в природе.
Давление
Насколько сложно и трудно понятие "температура", настолько просто и ясно понятие "давление". Его хорошо знает любой школьник из учебника физики. Давление показывает, какая сила действует на единицу площади поверхности. Направлено давление в случае газов и жидкостей всегда перпендикулярно к поверхности. Понятие "давление" можно применить к твердым телам, но следует помнить, что свойства твердых тел могут зависеть от направления, в котором действует давление (например, пьезоэффект).
В термодинамике давление и температура - два основных, главнейших параметра, определяющих состояние термодинамической системы. Это определение означает, что одна и та же масса вещества при одних и тех же значениях температуры и давления занимает всегда один и тот же объем. Правда, необходимо добавить: это определение справедливо, когда в системе достигнуто равновесное состояние.
Очень полезно знать, что один моль любого газа при 0° С и при нормальном атмосферном давлении 101,3 кПа занимает объем, равный приблизительно 22,4 л. Это стоит запомнить.
Теплота
Наверное, не одна сотня тысяч лет протекла с тех пор, как наши далекие предки впервые познакомились с огнем и научились сами получать теплоту. Каждый из нас грелся у горячей печки и мерз в стужу. Казалось бы, что может быть теперь привычнее и понятнее, чем так хорошо знакомая всем теплота.
Но вопрос: "Что такое теплота?" - далеко не так прост. Правильный ответ на него был найден наукой совсем недавно. Долгое время ученые даже не замечали всей сложности этой проблемы.
Первое истолкование природы теплоты было основано на бесспорном и очевидном как будто бы факте: при нагревании тела его температура повышается, следовательно, тело получает теплоту. При остывании, охлаждаясь, тело ее теряет. Поэтому всякое нагретое тело представляет собой смесь того вещества, из которого оно состоит, и тепла. Чем выше температура тела, тем больше в нем примешано теплоты. Теперь уже мало кто помнит, что слово "температура" в переводе с латинского и означает "смесь". Когда-то, например, о бронзе говорили, что она "температура олова и меди".
Два совершенно различных объяснения, две гипотезы о природе теплоты спорили между собой в науке почти два столетия. Первую из этих гипотез высказал в 1613 г. великий Галилей. Теплота - это вещество. Оно необычно. Оно способно проникать в любые тела и выходить из них. Тепловое вещество, иначе теплород, или флогистон, не порождается и не уничтожается, а только перераспределяется между телами. Чем его больше в теле, тем температура тела выше. Еще не так давно говорили - "градус теплоты" (а не температуры), считая, что термометр измеряет крепость смеси из материи и теплорода. (До сих пор еще сохранился обычай мерить в градусах крепость вина - смесь воды и спирта.)
Вторую гипотезу, совершенно, казалось бы, отличную от представления Галилея, высказал в 1620 г. английский философ Ф. Бэкон. Он обратил внимание на то, что было издавна известно любому кузнецу: под сильными ударами молота становится горячим холодный кусочек железа. Известен способ получения огня трением. Значит, ударами и трением можно произвести теплоту, не получая ее от уже нагретого тела. Бэкон из этого заключил, что теплота есть внутреннее движение мельчайших частиц тела и температура тела определяется скоростью движения частиц в нем. Эта теория получила в науке название механической теории теплоты. Для ее обоснования и развития очень много сделал гениальный русский ученый Михаил Васильевич Ломоносов.
При коренном расхождении обе гипотезы имеют немало сходства: из теории теплорода следовало, что термометр измеряет количество теплорода, содержащегося в теле; согласно же механической теории тепла, термометр показывает количество движения, содержащегося в теле. Согласно обеим теориям, должен существовать абсолютный нуль температуры. Он будет достигнут тогда, когда, по теории теплорода, от тела будет отнят весь теплород, а по механической теории - когда тело потеряет все содержащееся в нем движение.
Теория теплорода почти два века господствовала в науке. Она проста и наглядна. Но она ошибочна. Точное взвешивание тел при разных температурах показало, что теплота невесома. Невесомость теплоты хорошо согласовывалась с механической теорией тепла. Тогда думали, что движение никоим образом не может повлиять на массу тела. Правда, теперь мы знаем, что это не точно. Энергия, согласно закону Эйнштейна, эквивалентна массе; только соответствующая прибавка в массе лежит далеко за пределами даже современной точности взвешивания.
Не следует смешивать теплоту с тепловой энергией тела. Тепловая энергия тела определяется кинетической энергией движения его молекул. Но теплота (это очень важно) далеко не равна тепловой энергии. И еще более важно, что теплота вообще не содержится в теле. Теплоты от дров, горящих в печи, в дровах вообще не было. Теплота только переходит от одного тела к другому.
Совсем нетрудно подсчитать количество энергии хаотического теплового движения в системе, состоящей из молекул перегретого водяного пара, - это и будет его тепловая энергия. Но количество теплоты, которое может выделиться из этой системы при ее охлаждении, совсем не равно тепловой энергии: сначала охладится пар, потом он начнет конденсироваться в жидкую воду, затем охладится вода и, наконец, вода замерзнет. Теплота же испарения воды и теплота плавления льда очень велики. От перегретого пара, таким образом, можно получить гораздо больше теплоты, чем в нем содержится тепловой энергии.
Поэтому, строго говоря, обе гипотезы неверны -ни представление о теплоте как о тепловом веществе, ни механическая теория тепла. Вторая из них подтверждена опытом, но она не имеет никакого отношения к теплоте и касается только тепловой энергии, а это не одно и то же.
Работа
Совершать механическую работу — это значит преодолевать или уничтожать сопротивления: молекулярные силы, силу пружины, силу тяжести, инерцию материи и т. д. Истирать, шлифовать тело, разделять его на части, поднимать грузы, тянуть по дороге повозку, по рельсам поезд, сжимать пружину — все это значит совершать работу, это значит преодолевать в течение некоторого времени сопротивление. Совершать работу — это значит преодолевать сопротивление газа, жидкости, твердого тела, кристалла. Сжимать газ, жидкость, кристалл — это значит совершать работу.
Одним и тем же словом «работа» названы несходные явления, но за внешними различиями надо видеть общие основные черты. Работа связана с движением: груз поднимается, повозка перемещается, поршень скользит в цилиндре двигателя. Без движения нет работы. Работа связана с упорядоченным движением. Весь груз перемещается вверх. Вся повозка движется по дороге в одном направлении. Весь поршень в одном направлении движется в цилиндре. Работа невозможна без двух участников. Для поднятия одного груза должен опуститься другой груз, должна распрямиться пружина, должен расшириться газ. Оба участника движутся упорядоченно. Работа — это передача упорядоченного движения от одной системы к другой. Работа не связана только с механическим движением, а может совершаться и при изменении электрического или магнитного поля.
Способность системы совершать работу, конечно, очень важна для термодинамики. Но какую именно работу может совершить система — это для термодинамики несущественно. Как именно данную работу можно рассчитать и как ее измерить, должна сказать другая наука.
Определение механической работы дается в механике. Это определение знает каждый школьник: работа (А) равна произведению силы (F) на перемещение тела (l) в направлении действия силы.
Если же сила непостоянна, то приходится подсчитывать работу на каждом достаточно малом участке пути (математики говорят — на бесконечно малом), на котором силу можно считать постоянной:
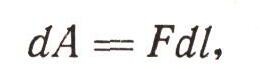
и затем просуммировать бесконечно малые значения работы по всему пройденному пути:
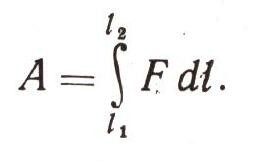
Тем, кто пугается математических формул, полезно запомнить, что знак интеграла - это просто вытянутая буква S - начальная в слове "сумма".
В физической химии часто рассматриваются процессы, связанные с дроблением вещества в тонкий порошок (пыль) или с возникновением из пара новой фазы тумана или дыма. При таких процессах возникает огромная новая поверхность множества мельчайших частиц, и на ее образование должна быть затрачена немалая работа. Эту работу нельзя не учитывать. Она равна произведению поверхностного натяжения (сигма) на площадь новой поверхности (S):
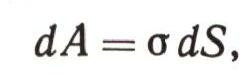
следовательно,
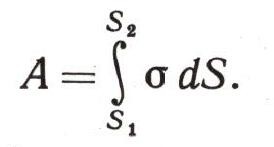
Такая работа затрачивается и при выдувании мыльного пузыря.
В теплотехнике при подсчете работы любых тепловых машин используется понятие работы расширяющегося газа, например водяного пара в цилиндре паровоза или в паровой турбине или газов в газовой турбине. Этот очень важный вид работы измеряется произведением давления газа на изменение его объема:
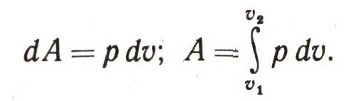
В электрохимии, например, известен другой вид работы. Электрическая работа аккумулятора или гальванического элемента равна произведению электродвижущей силы (Е) на изменение заряда (q):
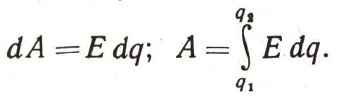
Полезно заметить и запомнить, что все выражения для различного вида работы очень сходны между собой. Любая работа обязательно измеряется произведением двух сомножителей: некоторой обобщенной силы f (это может быть сила всемирного тяготения, сила магнитного или электрического поля, давление, поверхностное натяжение, любые механические силы и т. д.) и величины а (изменение соответствующего параметра системы: перемещение, электрические заряды, площадь поверхности, объем и т. д.):
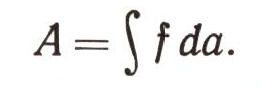
В задачи термодинамики не входит изучение различий между разными видами работы. Это рассматривается в других науках. Различных работ может быть очень много. Теплота только одна.
Теплота и работа
Пам нужно, чтобы машины для нас пахали землю, собирали урожай, мололи зерно, чтобы нас возили поезда и автомобили, чтобы по воздуху мчались самолеты, чтобы межпланетные корабли взлетали в космос, а подводные лодки изучали глубины океанов. Нам нужно, чтобы машины вгрызались в землю и добывали руду и уголь.
К одним из них мы должны подводить провода и направлять в их моторы электрический ток, полученный либо на тепловой электростанции, где за счет теплоты, выделяющейся при сгорании угля, рождается электроэнергия, либо на гидростанциях, где в турбинах энергия падающей воды, приобретенная ею только от теплоты солнечных лучей, превращается в энергию электрического тока. Другие машины нуждаются в топливе и работают за счет теплоты сгорания бензина, нефти, угля.
В реакторах атомных электростанций, атомного ледокола, атомных подводных кораблей выделяется при ядерном распаде огромное количество теплоты, за счет которой и работают их турбины и двигатели. Энергию атома мы пока умеем получать только в виде теплоты.
В системе (в атомном реакторе, в топке и котле паровой машины, в цилиндре автомобильного двигателя) теплоты нет, точно так же в ней нет и работы. Движение не было теплотой, пока оно содержалось в горячем теле, движение не стало теплотой, когда оно вошло в холодное тело и нагрело его. Теплота - это не свойство системы. И о теплоте, и о работе можно говорить только в связи с процессом и во время процесса, совершаемого системой, но не в связи с ее состоянием. Теплота и работа подобны ; и та и другая - это передача движения из одной системы в другую. В этом их сходство.
Различие между ними велико и принципиально. Теплота - это передача хаотического, беспорядочного движения молекул. Такая передача происходит всегда только от нагретого тела к холодному. Работа - это передача упорядоченного, направленного движения.
Как превратить в упорядоченное возможно большую часть хаотического движения, как с помощью тепла получить наибольшее количество работы -это важная задача термодинамики.
Пример расчета очень важной работы
В качестве примера рассчитаем работу изотермического расширения идеального газа. Хотя для этого и придется иметь дело с интегрированием, пугаться не следует. Те, кто внимательно прочитал том 2 ДЭ, с этой задачей легко справятся.
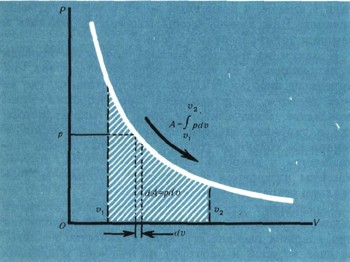
Работа расширения любого тела, а следовательно, и любого газа при бесконечно малом изменении его объема dA = pdu. По уравнению идеального газа pv = RT можно определить его давление:
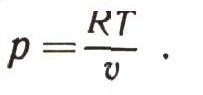
Следовательно, работа расширяющегося идеального газа при бесконечно малом изменении его объема будет:
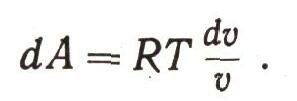
Работа, совершенная при расширении одного моля идеального газа от малого объема и1 до большого u2'
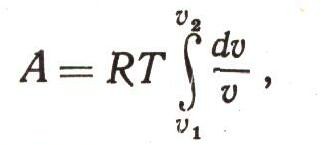
а это выражение равно:
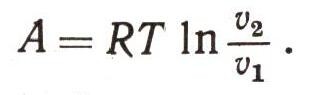
Это одна из важных формул термодинамики. Области ее применения буквально неисчислимы.
Энергия
Повсюду, в любом теле, существующем в мире, при любой температуре, молекулы и атомы находятся в непрерывном движении. Сумма их кинетических энергий определяет тепловую энергию тела. Даже и при абсолютном нуле сохраняется молекулярное колебательное движение. При абсолютном нуле всякое тело поэтому обладает энергией. Она так и называется нулевой энергией. Эта энергия очень мала, но пренебрегать ею нельзя: она играет очень важную роль в квантовых расчетах химических равновесий.
Потенциальная энергия взаимодействия атомов в молекулах или в кристаллической решетке тела -это запас его химической энергии. Ее можно определять по-разному. Можно, например, подсчитать энергию, необходимую для того, чтобы разрушить вещество тела на отдельные молекулы, разорвав в нем межмолекулярные связи. Затем, нарушив межатомные химические связи, разделить молекулы на атомы и разбросать все атомы на бесконечно большое расстояние, так, чтобы они не взаимодействовали между собой. Только ни один инженер не согласится с таким способом подсчета энергии в топливе. Ему от такого способа, важного и нужного для теоретика, очень мало пользы. Инженер-практик предпочтет просто-напросто сжечь уголь и измерить количество выделившегося тепла.
Физик, подсчитывая энергию тела, задумается о ее запасах, скрытых в атомах, образующих тело. Он получит разные результаты, учитывая либо только энергию ядерного расщепления, либо принципиально возможную, хотя пока еще недостижимую энергию аннигиляции.
Но ведь любое тело, брошенное наклонно вверх, пока летит, обладает, кроме того, собственной кинетической энергией поступательного движения и изменяющейся потенциальной энергией в поле притяжения Земли. Спутник, выведенный на орбиту, сохраняет приданную ему энергию. Упавший камень не остается в покое. Он участвует в сложном движении поверхности земного шара: вращаясь вместе с ним, летит вокруг Солнца, уносится с Солнечной системой в галактическом движении, летит вместе с Галактикой в глубину космоса... Каждому движению соответствует своя доля энергии.
Чему же равна энергия тела? Теплотехник не обращает внимания на запасы химической энергии водяного пара. Ведь использовать их он не может: вода в котле остается только водой, хотя и превращается в пар.
Химика не интересует скрытая в атомах ядерная энергия. Ее запасы в исходных веществах и продуктах реакции одни и те же. Атомы до химической реакции и после нее остаются в колбах химика или в его заводских аппаратах теми же самыми атомами. И химикам, и физикам, и инженерам в голову не придет обращать внимание на движение их реторт, атомных реакторов, тепловых машин вместе с Землей в космосе. Ведь все эти аппараты неподвижны относительно земной поверхности. Но астрофизик, изучающий тайны рождения звезд, уже не может пренебрегать энергией движения исследуемых им тел в космосе.
Несомненно, наука проникнет еще дальше и в глубь атома. Будут открыты новые, еще неизвестные структурные элементы ядерных частиц. Их энергия связи, конечно, будет превышать энергию связи атома. Этот процесс расширения нашего познания никогда не завершится - вещество неисчерпаемо...
Чему же равна энергия тела? Так поставленный вопрос смысла не имеет и термодинамику не интересует.
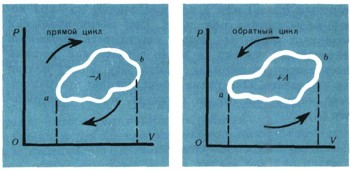
Термодинамический цикл
Попробуйте представить себе какую угодно термодинамическую систему. Вообразите себе хотя бы один моль газа, или десять молей воды (почти один стакан), или что вам угодно. Чтобы перевести любую систему из одного состояния в другое, с ней нужно что-то сделать: либо совершить над ней работу, либо, наоборот, предоставить системе произвести работу и при этом либо нагреть систему - передать тепло, либо охладить ее - тепло отнять. Если, нагревая стакан воды, превратить ее в пар при постоянном давлении, придется не только затратить тепло, но и произвести немалую работу. Работу образовавшегося и расширяющегося пара подсчитать нетрудно: он приподнимает весь слой атмосферного воздуха вплоть до границ стратосферы.
Теперь представьте себе, что вы проделали с вашей системой тысячи самых разнообразных операций: вы могли ее охлаждать, нагревать, сжимать, расширять, электризовать, намагничивать... Пусть при этом протекают какие угодно превращения и какие угодно химические реакции, но только при одном условии: пусть после всего этого система вернется точно в свое исходное, первоначальное состояние. Термодинамический процесс, каким бы он сложным ни был, из скольких бы промежуточных стадий ни состоял, в результате которого система возвращается в свое исходное состояние, называется термодинамическим циклом. Это одно из самых важных понятий термодинамики.
В результате проведенного термодинамического цикла в системе ничего не изменилось: физическое состояние и строение всех ее частей, движение всех ее молекул - все вернулось к исходному положению, и с нашей системой ничего не произошло.
Но ведь в процессе цикла была совершена работа либо самой системой (при расширении пара), либо над системой (при сжатии газа). Алгебраическая сумма всех работ на всех этапах цикла - это и есть полученная работа. Кроме того, поглощалась теплота (при испарении воды) или она выделялась (при конденсации пара), алгебраическая сумма всей теплоты на всех этапах цикла - это поглощенная системой теплота.
Что же все-таки в итоге цикла произошло? Куда исчезла теплота? Откуда взялась работа?
2i.SU ©® 2015